
8月26日,CDE承办了复宏汉霖递交的斯鲁利单抗注射液上市申请,注册分类为2.2类。根据复宏汉霖中期业绩报告,斯鲁利单抗联合化疗用于一线治疗食管鳞癌的III期研究已达到主要研究终点,该公司计划于2022年下半年递交该适应症的上市注册申请。
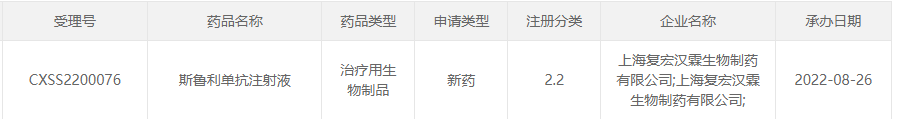
截图来源:CDE官网
斯鲁利单抗(H药,Serplulimab,HLX10)最早于2022年3月24日获NMPA附条件上市,用于单药治疗经标准治疗失败后、不可切除、转移性高度微卫星不稳定型(MSI-H)实体瘤患者。是第七款获批上市的国产PD-1抑制剂,也是国内首款国产“不限癌种”PD-1抑制剂。
复宏汉霖发布的半年报显示,截至2022年6月底,斯鲁利单抗实现销售收入约人民币7690万元。对于斯鲁利单抗是否会参与今年的国家医保谈判,复宏汉霖近日表示,正积极筹备国谈,会根据具体的形势来决定是否参与每一轮的国谈,将惠及患者、适应证等方方面面因素考量进去来决策。
此次并非斯鲁利单抗首次递交2.2类上市申请。今年4月,CDE受理了斯鲁利单抗新适应症的上市申请,联合化疗一线治疗广泛期小细胞肺癌。而在2021年9月,斯鲁利单抗还递交了适应症为一线治疗鳞状非小细胞肺癌的上市申请并获受理,注册分类为1类。目前这2项申请均在审评审批中。
据复宏汉霖的2022半年报,针对斯鲁利单抗,复宏汉霖正在全球同步开展11项联合疗法临床试验,广泛覆盖肺癌、食管癌、头颈癌和胃癌等高发大瘤种。与此同时,今年斯鲁利单抗还递交了4项临床试验申请,其中3项获得临床试验默示许可,适应症分别为:
1️⃣局限期小细胞肺癌
2️⃣联合HLX07(重组抗EGFR人源化单克隆抗体注射液)以及联合HLX04(重组抗VEGF人源化单克隆抗体注射液)一线治疗不可切除或转移性肝细胞癌(HCC)
3️⃣联合HLX26单抗注射液(抗LAG-3单克隆抗体)治疗晚期/转移性实体瘤或淋巴瘤
除此之外,今年复宏汉霖还有7款新药获得临床试验默示许可(含申报新适应症/联合用药在内),均为抗肿瘤药物。其中除HLX208片为化药外,其他均为治疗用生物制品。
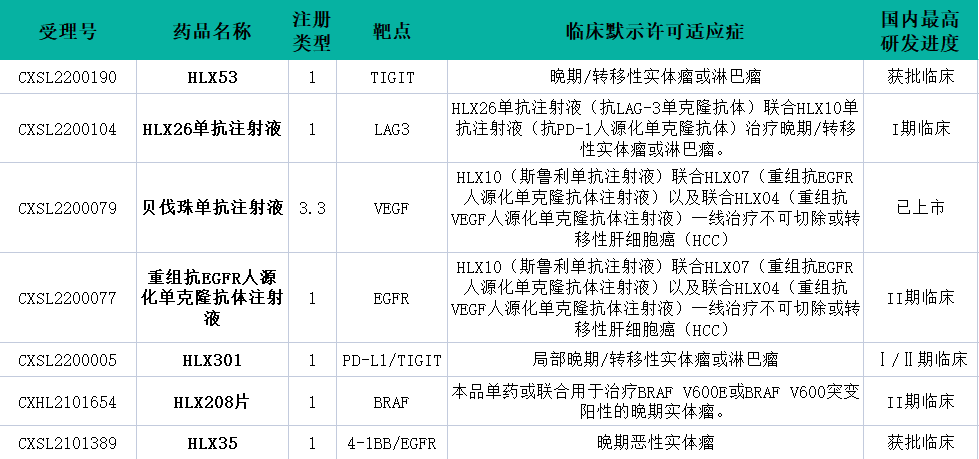
数据来源:药融云数据库
参考来源:
[1] CDE官网
[2] 药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论