
3月14日,港股创新药企基石药业(HK:2616)宣布,选择性RET抑制剂普吉华®(普拉替尼胶囊)的扩展适应症申请已经获得中国国家药品监督管理局(NMPA)批准。该项扩展适应症包括需要系统性治疗的晚期或转移性转染重排(RET)突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者的治疗,以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌(TC)成人和12岁及以上儿童患者的治疗。
据药融云数据库显示,普吉华®是RET抑制剂,是基石药业首个获批的产品,也是国内首个获批上市的选择性RET抑制剂。据统计,2021年第三季度,普吉华®在我国院内的销售额有接近70万元,是一款非常有潜力的药品。
普拉替尼基本信息

截图来源:药融云全球药物研发数据库
据了解,这是继2021年3月 NMPA批准基石药业普吉华®用于既往接受过含铂化疗的RET融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)后,普吉华®成功拓展适应症。普吉华®同时也是中国首个且唯一获批用于RET突变MTC及RET融合阳性TC的选择性RET抑制剂。
在业内看来,此次获批不仅表明中国RET突变型MTC患者及RET融合阳性TC患者首次获得了精准治疗方案,也意味着随着新适应症的拓展,基石药业首款获批产品普吉华®应用患者人群大幅增加,商业化前景更加值得期待。
甲状腺癌及甲状腺髓样癌治疗趋向精准化
普吉华®扩展适应症获批
针对此次普吉华®扩展适应症在中国上市申请获批,基石药业董事长兼首席执行官江宁军博士表示:“我们很高兴普吉华®扩展适应症获批,为中国RET突变甲状腺髓样癌及RET融合阳性甲状腺癌患者带来新的治疗选择。基石药业始终致力于研发创新药物,满足癌症患者未解决的医疗需求。我们将持续增强管线研发的临床价值和市场潜力,加速为全球患者带来更多高品质的新药。”
2020年9月,美国食品药品监督管理局(FDA)批准普吉华®用于治疗转移性RET融合阳性非小细胞肺癌成人患者,同时普吉华®落地博鳌,成为博鳌乐城首个当月与美国同步落地的全球新药。
2021年3月,NMPA批准同类首创精准治疗药物普吉华®的上市申请,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性NSCLC成人患者的治疗。同时,普吉华®也是我国首个使用乐城真实世界数据辅助审评审批的药物。
据了解,此次普吉华®拓展适应症的获批是基于一项全球I/II期ARROW临床研究,旨在评估普吉华在RET融合阳性的NSCLC、RET突变型MTC和其他RET融合的晚期实体瘤患者中的安全性、耐受性和有效性的全球临床研究。研究显示,普吉华®耐受良好,在中国患者中整体安全可控,且没有发现新的安全信号。
近几年,TC发病率显著上升,根据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据显示,它是2020年中国癌症新发病例数前十癌症之一,2020年,中国约有22万新发病例数,其中女性新发病例数约为17万,其发病率位居我国城市地区女性所有恶性肿瘤的第4位。
普吉华®ARROW研究主要研究者、天津市人民医院院长高明教授表示,临床上对MTC治疗手段有限,亟待精准靶向尤其是针对RET突变MTC患者的治疗方案。“普吉华®在晚期或转移性RET突变MTC中国患者中显示出了优越和持久的抗肿瘤活性,整体安全性与全球人群相似。随着普吉华®扩展适应症在中国的获批上市,我们期待能够解决更多甲状腺癌患者亟待满足的临床需求。”
普吉华®应用患者人群大幅增加
商业化前景进一步凸显
基石药业首席医学官杨建新博士表示,普吉华®扩展适应症的获批是继其获批用于RET基因融合阳性的局部晚期或转移性NSCLC之后的又一重要里程碑。“我们还将继续推进普吉华®在其他多种肿瘤中的临床研究,早日将更多的创新疗法惠及更多患者。”
据悉,基石药业还在探索RET抑制剂的篮子试验。所谓“篮子试验”(basket trial),即不再按患癌组织来选择受试患者,而是按照肿瘤的驱动基因来选择临床试验对象,正所谓“异病同治”,“不限癌种”,普吉华®未来的医疗价值和商业潜力可见一斑。
作为基石药业首款获批产品,该产品获批上市即取得不错的商业化效果。基石药业2021半年报显示,普吉华®在上市不到两个月的时间里就达到了4580万元的销售业绩。更值得一提的是,第一天上市就在近百家医院有200多位病人用到了这个救命药。
据了解,基石药业已通过与医疗服务提供方、医院、药房、保险公司以及医疗界的其他团体合作,扩大药品的市场辐射范围,目前已覆盖130多个城市的400多家医院。不仅如此,该产品已纳入超60个主要省市的商业保险中,包括北京京惠保、成都惠蓉保、苏州苏惠保、海南乐城、珠海大爱无疆等,进一步提升产品的可及性。
而此次该产品适应症进一步拓展,在业内看来,对于基石药业来讲,普吉华®应用患者人群将随着适应症的拓展大幅增加,未来将释放出更大的市场潜力。
实际上,已商业化产品的多适应症拓展,目前已经成为基石药业在管线布局中重要的一环。
经药融云数据库查询,基石药业继普吉华®(普拉替尼胶囊、pralsetinib)之后,同类首创精准治疗药物泰吉华®(阿伐替尼片、avapritinib)、全球首个潜在同类最优PD-L1抗体药物择捷美®(舒格利单抗注射液、sugemalimab)以及国内首个IDH1抑制剂拓舒沃®(艾伏尼布片、ivosidenib)相继获批,基石药业一年之内已经在中国成功获批上市四款创新药,均在不断拓展产品适应症。
基石药业中国已上市产品
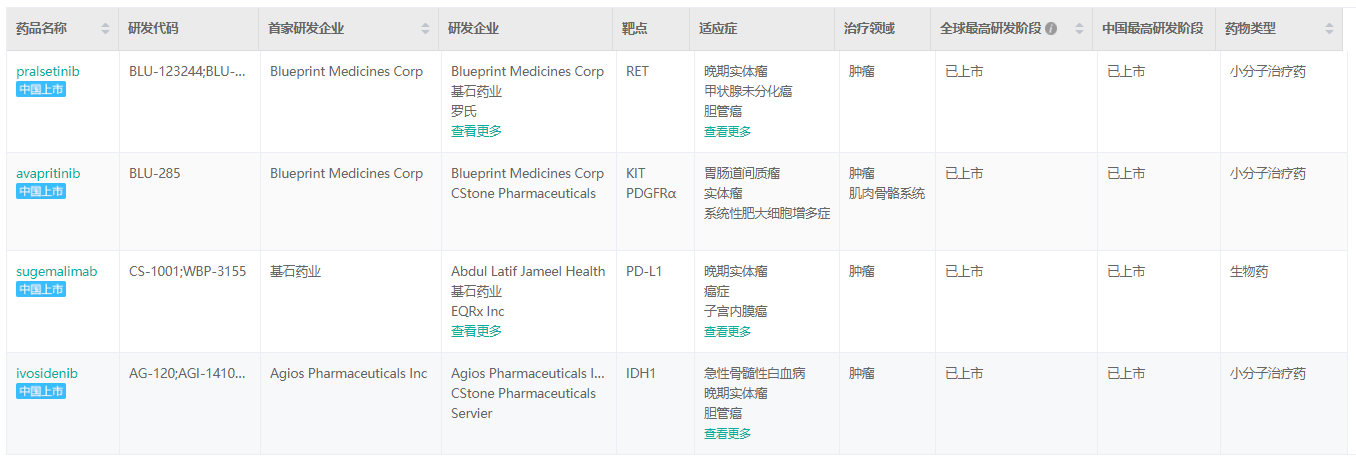
截图来源:药融云全球药物研发数据库
除了此次获批的普吉华®拓展新适应症外,泰吉华®是中国首个获批也是全球首款针对PDGFRA外显子18突变型胃肠道间质瘤(GIST)的精准治疗药物,其用于晚期系统性肥大细胞增生症的适应症已在美国获批;择捷美®也正在拓展新的适应症,不但有望成为全球首个对III期和IV期NSCLC均潜在有效的PD-(L)1单抗,且同时对胃癌、食管癌和淋巴瘤也表现出不错疗效;前不久刚刚获批上市的拓舒沃®,适应症为复发或难治性急性髓系白血病(AML),该产品多项临床研究正在开展中,包括用于一线治疗AML、携带IDH1易感突变的复发难治性骨髓增生异常综合征的成人患者(MDS)、晚期胶质瘤、胆管癌等多个适应症。
想要解锁更多药企药物最新信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企药物产品布局、研发阶段、申报情况、最新进展、涉及靶点适应症、市场规模与前景、可否投入研发与仿制!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论