
中国杭州,2022年3月1日——葆元医药(“葆元”),一家专注于开发新型精准肿瘤疗法的临床阶段全球性生物制药公司,与信达生物制药(“信达生物”,港交所代码:01801),一家致力于研发、生产和销售用于治疗肿瘤、代谢疾病、自身免疫等重大疾病的创新药物的生物制药公司,今日联合宣布,他雷替尼(Taletrectinib,葆元研发代码:AB-106,信达研发代码:IBI-344)已被中国国家药品监督管理局(NMPA)药品评审中心(CDE)纳入突破性治疗药物品种名单,拟定适应症为既往未经ROS1酪氨酸激酶抑制剂(TKI)治疗和既往接受ROS1 TKI治疗失败的 ROS1 融合阳性非小细胞肺癌患者。
他雷替尼是新一代、同类最佳的强效 ROS1 抑制剂,本次被纳入突破性治疗药物品种,是基于其治疗ROS1 融合阳性非小细胞肺癌患者的 2 期 TRUST 临床试验结果。根据葆元在2021年度中国临床肿瘤协会会议(CSCO)上展示的数据显示(截至日期:2021年6月16日,患者入组后至少接受过2次肿瘤评估),既往未经克唑替尼治疗患者组(N=21)的客观缓解率(ORR)为90.5%(19/21),疾病控制率(DCR)为90.5%(19/21)。既往接受克唑替尼治疗失败患者组(N=16)的ORR为 43.8%(7/16),DCR为 75.0%(12/16)。此外,他雷替尼在对克唑替尼耐药的 G2032R 突变患者中显示了令人鼓舞的疗效,在脑转移患者中也具有颅内抗肿瘤活性,并且只有少量神经系统不良事件。他雷替尼耐受性良好,其治疗相关的不良事件主要包括胃肠道不良事件和可逆的天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)升高。

葆元医药的联合创始人兼首席医疗官颜冰医学博士表示:“ ROS1 融合突变肺癌患者的医疗需求远未被满足。他雷替尼在ROS1 融合突变患者中的2 期试验结果令人鼓舞,为我们今后针对该适应症提交监管部门审批提供了坚实的基础。”

信达生物高级副总裁周辉博士表示:“我们很高兴他雷替尼的2期试验数据通过了国家药品监督管理局突破性治疗药物品种的评审。ROS1 融合阳性患者现有的治疗手段非常有限。他雷替尼已显示出良好的疗效和安全性结果,有可能成为这些患者急切期盼的新型疗法。我们非常期待目前的 2 期试验能提供更多数据,早日为 ROS1 融合阳性非小细胞肺癌患者带来希望。
国家药品监督管理局突破性治疗药物评审是为了加快开发针对严重疾病、且在初步临床试验中显示出疗效显著优于现有治疗手段的新药而设计的。突破性治疗药物评审不仅可以让候选药物获得快速审评,还可以让申办方及时获得药品评审中心的建议和沟通,加快药品的批准和上市进程,以解决患者的临床治疗需求。查看已纳入突破性治疗品种名单,可访问https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
关于他雷替尼(Taletrectinib)
他雷替尼基本信息

截图来源:药融云全球药物研发数据库
他雷替尼是一种新型的、同类最优的新一代 ROS1 抑制剂,旨在有效靶向治疗ROS1 融合突变,具有治疗既往未经ROS1 TKI治疗患者和既往接受ROS1 TKI治疗患者的潜力。据估计,ROS1基因融合突变是约1%至2%的非小细胞肺癌患者的致癌驱动因素。ROS1 融合也会在其他类型癌症中出现,例如胆管癌、胶质母细胞瘤、卵巢癌、胃癌和结肠直肠癌等。他雷替尼在ROS1 融合阳性非小细胞肺癌患者中表现出优异的抗克唑替尼耐药性、良好的脑渗透和颅内抗肿瘤活性以及良好的安全性。在这些患者中只观察到少量神经系统不良反应,这可能得益于他雷替尼对 ROS1 而非 TRKB 的选择性抑制。
据药融云数据库显示,他雷替尼针对转移性非小细胞癌和实体瘤的适应症目前处在临床二期试验,针对中枢神经系统肿瘤的适应症还在临床前阶段。
他雷替尼适应症研发 阶段
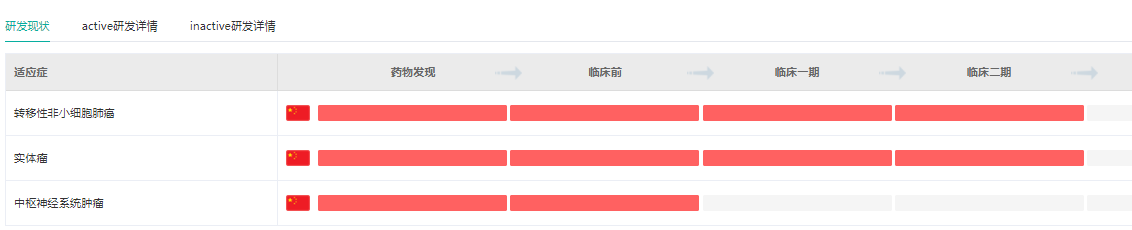
截图来源:药融云全球药物研发数据库
关于葆元医药
葆元医药(“葆元”)是注册于开曼群岛(注册名AnBio Therapeutis Ltd.)的一家临床阶段的全球性生物制药集团公司,致力于开发广泛的创新性新一代精准肿瘤治疗药物管线,用于医疗需求满足程度较低的领域。其主要研发药物他雷替尼是新一代同类中最优的 ROS1 抑制剂,目前正处于 2 期试验,用于治疗 ROS1 融合阳性非小细胞肺癌的既往未经ROS1 TKI治疗和既往接受 ROS1 TKI 治疗的患者。公司的产品管线还包括:AB-218,一种处于2期试验的 mIDH1抑制剂,具有良好的脑渗透性,可用于治疗具有 mIDH1突变的多种实体瘤;AB-329,一种处于1期研究的 AXL 抑制剂,可用于与检查点抑制剂或化疗联合使用治疗非小细胞肺癌或其他实体肿瘤。
经药融云查询,葆元医药产品管线除他雷替尼外,还有两款药物在研。DS-1001,ICDm靶点,针对胶质瘤的适应症处于临床二期试验阶段;DS-1205c,AXL靶点,针对转移性非小细胞肺癌、转移性乳腺癌、卵巢肿瘤的适应症处于临床一期试验阶段。
葆元医药产品管线

截图来源:药融云全球药物研发数据库
关于信达生物
“始于信,达于行”,开发出老百姓用得起的高品质生物药,是信达生物的理想和目标。信达生物成立于2011年,致力于开发、生产和销售用于治疗肿瘤、自身免疫、代谢疾病等重大疾病的创新药物。2018年10月31日,信达生物制药在香港联合交易所有限公司主板上市,股票代码:01801。
自信达生物的成立以来,公司凭借创新成果和国际化的运营模式在众多生物制药公司中脱颖而出。建立起了一条包括29个新药品种的产品链,覆盖肿瘤、代谢疾病、自身免疫等多个疾病领域,其中7个品种入选国家“重大新药创制”专项。经查询,信达生物公司已有 6个产品获批上市(信迪利单抗注射液,商品名:达伯舒®,英文商标:TYVYT®;贝伐珠单抗生物类似药,商品名:达攸同®,英文商标:BYVASDA®;阿达木单抗生物类似药,商品名:苏立信®,英文商标:SULINNO®;利妥昔单抗生物类似药,商品名:达伯华®,英文商标:HALPRYZA®; pemigatinib口服抑制剂,商品名:達伯坦®,英文商标:PEMAZYRE®; 奥雷巴替尼,商品名:耐立克®)获得批准上市,6个品种进入III期,另外还有超20款产品已进入临床研究。
信达生物研发管线
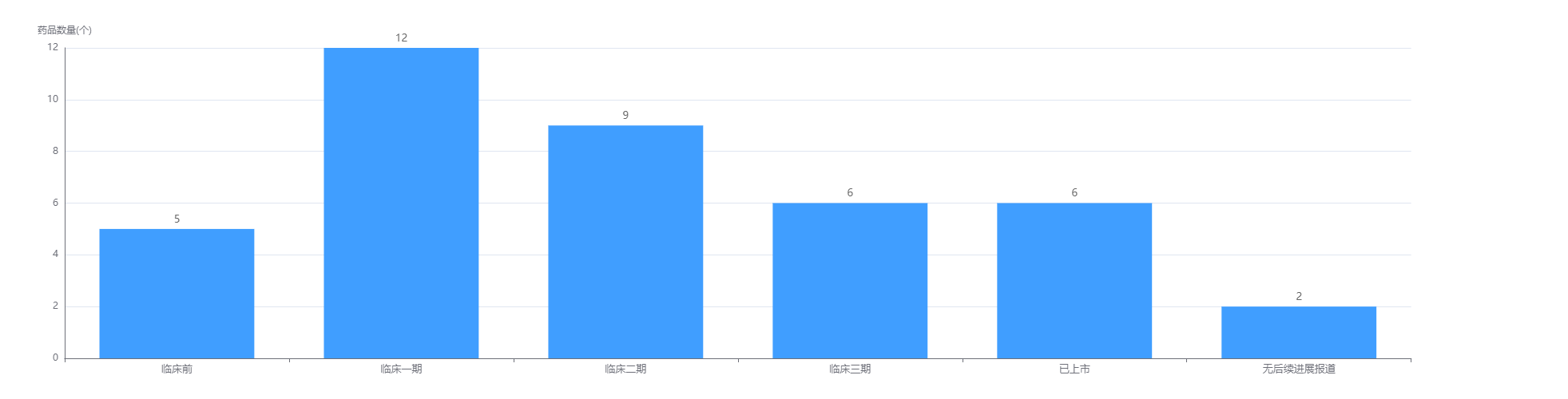
截图来源:药融云全球药物研发数据库
信达生物已组建了一支具有国际先进水平的高端生物药开发、产业化人才团队,包括众多海归专家,并与美国礼来制药、Adimab、Incyte、MD Anderson 癌症中心和韩国Hanmi 等国际合作方达成战略合作。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。
声明:
1. 该适应症为研究中的药品用法,尚未在中国获批;
2. 信达不推荐任何未获批的药品/适应症使用;
3. 仅供医疗卫生专业人士交流使用。
信达生物的前瞻性陈述
本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用“预期”、“相信”、“预测”、“期望”、“打算”及其他类似词语进行表述时,凡与本公司有关的,目的均是要指明其属前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述乃基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。
本公司、本公司董事及雇员代理概不承担 (a) 更正或更新本网站所载前瞻性表述的任何义务;及 (b) 若因任何前瞻性表述不能实现或变成不正确而引致的任何责任。
想要解锁更多药企药物最新信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企产品管线、研发阶段、最新进展、药物涉及靶点、市场规模与前景、可否投入研发与仿制!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论