8月17日,诺诚健华和Incyte公司联合宣布,诺诚健华旗下一家子公司和Incyte公司就一款靶向CD19的Fc结构域优化的人源化单克隆抗体tafasitamab在大中华区的开发和商业化签订了合作和许可协议。

根据协议条款,诺诚健华将向Incyte支付3500万美元首付款。此外,Incyte有资格获得至多 8250 万美元潜在的开发、注册和商业化里程碑付款,以及分级销售分成。两家公司的领导均对此次交易表示充分的肯定。
Incyte首席执行官Hervé Hoppenot说:“此次与诺诚健华合作将加速双方合作药物在中国的发展。我们相信,诺诚健华将成为我们卓越的合作伙伴,有助于加速tafasitamab的开发。Tafasitamab将来获批后,将有助于把这种创新疗法提供给大中华区的医生和患者。
诺诚健华联合创始人、董事长兼CEO崔霁松博士说:“我们很荣幸也很高兴能和Incyte展开合作。Tafasitamab已经在美国获批,我们将致力于推进tafasitamab在中国的获批,造福大中华区患者。双方的战略合作不仅将增强我们在血液瘤和实体瘤领域的实力,也为探索BTK 抑制剂奥布替尼和 tafasitamab 联合用药造福更多患者提供了良好的机会。我们相信,新型 CD19 抗体药物tafasitamab对于增强我们大分子管线实力的长期发展战略十分重要。我们也将迅速探索tafasitamab与我们现有产品管线联合用药的潜力,更好地发挥协同效应。”
一、关于Tafasitamab
Tafasitamab 是一款靶向CD19的Fc结构域优化的人源化单克隆抗体,包含 Xencor 公司独有的XmAb® 工程化Fc结构域,因此显著强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),通过细胞凋亡和免疫效应机制介导B 细胞肿瘤的裂解。
2020年7月31日,美国食品和药物管理局(FDA)首次批准了Tafasitamab(商品名MONJUVI®),与来那度胺联合应用,用于治疗成人复发或难治性弥漫性大B细胞淋巴瘤(DLBCL),包括低度淋巴瘤引起的DLBCL,以及不符合自体干细胞移植(ASCT)条件的患者。有研究结果显示,Monjuvi与来那度胺联用,达到55%的总缓解率(ORR),包括37%的完全缓解率和18%的部分缓解率。中位缓解持续时间(mDOR)为21.7个月。
2010年,MorphoSys从Xencor获得了开发tafasitamab的全球独家权益。Tafasitamab利用了名为XmAb的Fc结构域改造技术,通过改造抗体的Fc端,能够将抗体与Fcγ受体的亲和力提高40倍,从而更好地激活先天杀伤细胞(NK cells)、巨噬细胞等免疫细胞,通过抗体依赖性细胞介导的细胞毒性(ADCC),和抗体依赖性细胞吞噬作用(ADCP)介导B细胞裂解。FDA此前授予Monjuvi和来那度胺联合治疗复发/难治性DLBCL的快速通道和突破性疗法认定和优先审评资格。
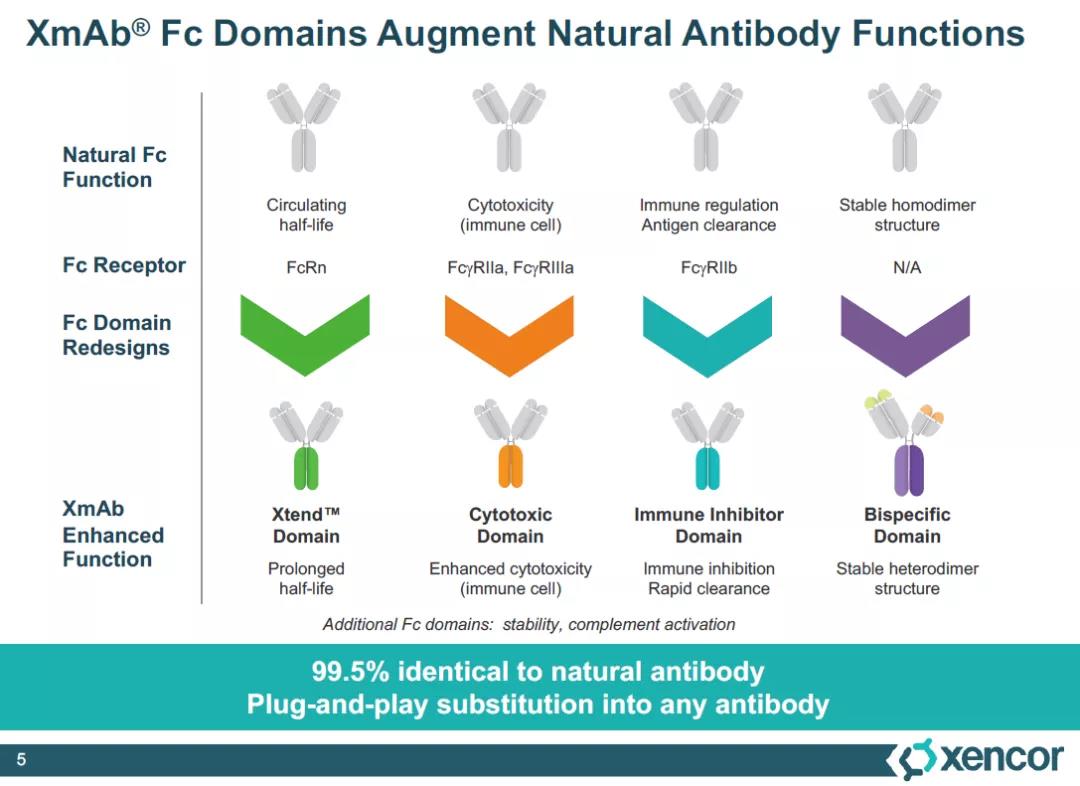
▲XmAb技术平台能够通过改造Fc结构域增强抗体的多种特征(图片来源:Xencor官网)
二、关于诺诚健华
诺诚健华于2015年由施一公以及前美国默克集团心脏病学研发总监崔霁松通过个人提供资金及注资共同创办,其核心团队10个成员中,除CFO外的其他9名成员均为博士,非常亮眼的明星团队获得了资本的青睐。2020年3月23日,诺诚健华正式在港交所挂牌上市,股票代码为09969。
2020年财报显示,诺诚健华收入和其他收益由2019年的1.057亿元增加至2020年的2.727亿元。随着奥布替尼获批上市,2021年公司收入来源将更加多元化。诺诚健华产品管线丰富,核心产品奥布替尼有着广阔的市场前景,但是BTK抑制剂确实在国内外都面临着激烈的竞争,积极推动奥布替尼适应症范围扩大成了当务之急。
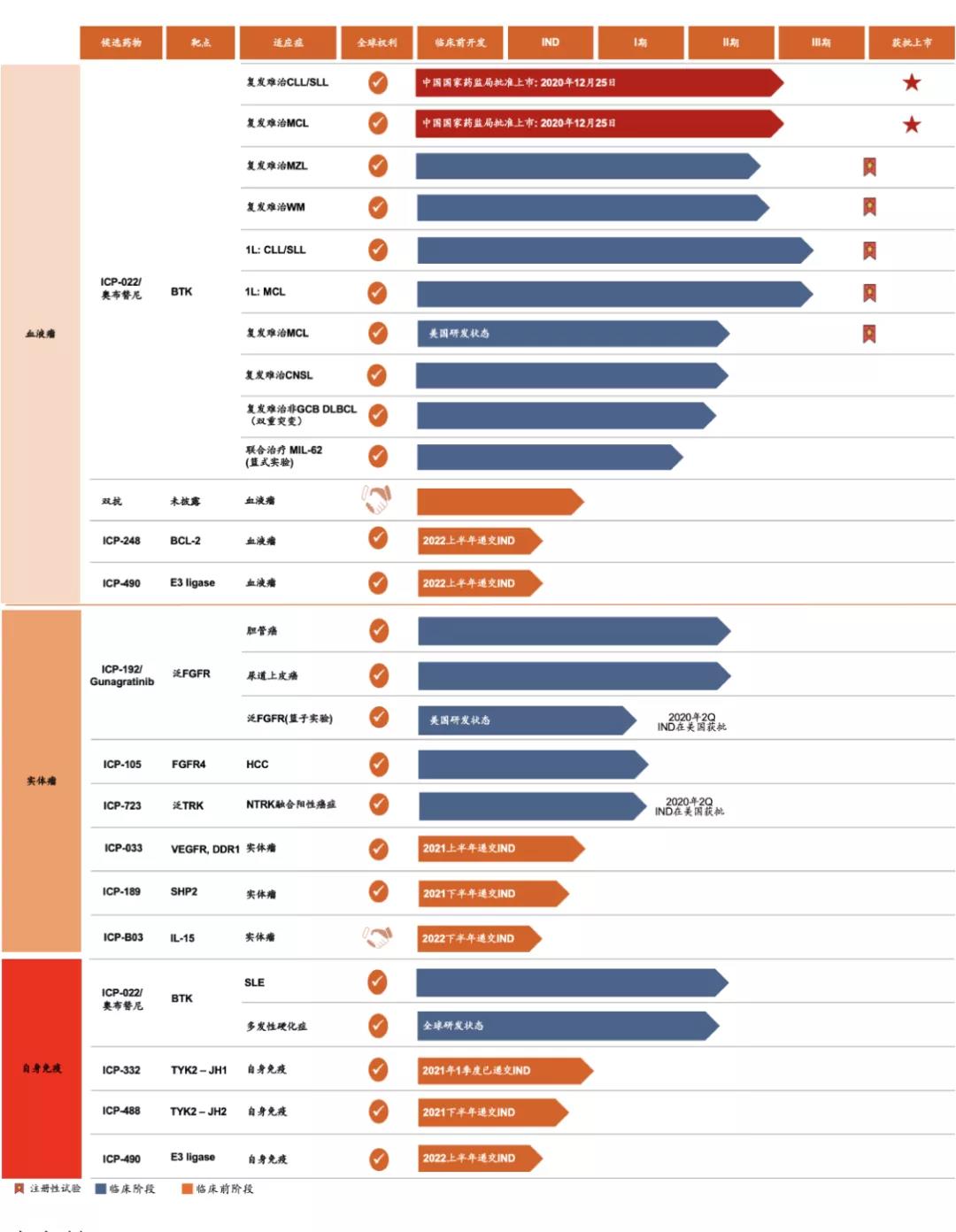
诺诚健华研发管线
三、奥布替尼9.4亿美元“出海”BTK抑制剂市场潜力巨大
2021年7月12日,渤健和诺诚健华联合宣布,两家公司就有望治疗多发性硬化(MS)的口服小分子布鲁顿酪氨酸激酶抑制剂(BTKi)奥布替尼达成许可及合作协议。诺诚健华将获得 1.25 亿美元首付款,以及在达到合作约定的开发里程碑、商业里程碑以及销售里程碑时,有资格获得至多 8.125 亿美元的潜在临床开发里程碑和商业里程碑付款。
根据协议条款,渤健将拥有奥布替尼在多发性硬化领域全球独家权利,以及除中国(包括香港、澳门和台湾)以外区域内的某些自身免疫性疾病领域的独家权利,诺诚健华将保留奥布替尼在肿瘤领域的全球独家权利,以及某些自身免疫性疾病在中国(包括香港、澳门和台湾)的独家权利。此次交易的9.4亿美元也创造国内小分子新药License-out的新纪录。

奥布替尼是诺诚健华自主研发的具高度选择性和血脑屏障渗透能力的BTK抑制剂,2020年12月,奥布替尼片(商品名:宜诺凯)获得中国国家药监局批准,用于治疗复发/难治慢性淋巴细胞白血病(R/R CLL)/小淋巴细胞淋巴瘤(R/R SLL)、以及复发/难治套细胞淋巴瘤(R/R MCL)两项适应症,是国内第三款获批的BTK抑制剂。
除去肿瘤相关的适应症,奥布替尼也正在开发用于自身免疫性疾病的治疗。由于可透过血脑屏障,在中枢神经系统实现高靶点占有率,具有抑制中枢神经系统中B细胞和髓样细胞的功能的潜力,有望为所有多发性硬化(MS)亚型的疾病进展提供有益的临床价值。根据多发性硬化国际联合会(MSIF)于2021年1月发布的数据,目前全球MS患者超过280万人,全球MS市场规模2018年达到230亿美元,预计到2030年接近500亿美元。这也是此次出海大获成功的原因。
四、4款药物在临床,其中2款处国内第一梯队
除去已上市的奥布替尼,诺诚健华旗下还有丰富的在研管线。其中ICP-723、ICP-192、ICP-105和ICP-332处于临床I/II期,分别针对TRK、FGFR、FGFR4和TYK2靶点。ICP-332片于7月26日刚开展临床一期。
值得一提的是,ICP-192和ICP-105目前都处于国内第一梯队:
在国内范围,ICP-192是除erdafitinib以外,临床进展最快的泛FGFR抑制剂。
而在FGFR4抑制剂上,在国内只有诺诚健华的ICP-105与基石药业的CS-3008进入了临床试验阶段。
五、结语
综上所述,我们可以看出诺诚健华是一家非常优秀的创新药企,此次首付款高达3500万美元的License-in项目,也将为其带来极大助力,未来可期。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论