
近年来,小核酸药物因特异性强、设计简便、研发周期短、靶点丰富等优点,成为当前生物医药领域研究的热点;小核酸药物的重点是清除与遗传疾病相关的某些蛋白质,它主要是针对靶基因,而大多数小分子药物并不是针对靶基因。小核酸药物专指靶向作用于RNA或蛋白质的一类寡核苷酸分子,包括反义寡核苷酸(ASO)、siRNA、aptamer等,反义寡核苷酸(ASO)通常是由15~25个核苷酸组成,并且进行了某些化学修饰的短链核酸,它的碱基通过(watson-crick)碱基互补配对原则与靶标形成双链结构。siRNA 是生物宿主对外源侵入基因表达的双链RNA 进行切割所产生的具有特定长度(21-25bp)和特定序列的小片段RNA,小干扰 RNA被发现以来一直广泛认为能够沉默许多或所有基因的核糖核酸。
虽然小核酸药物可以针对大部分小分子无法达到的靶标,但它也会面临很大的挑战。第一,小核酸药物很容易被体内的核酸酶降解,据研究显示,未修饰或未被封装的小核酸药物的半衰期仅10min;第二,小核酸药物缺乏靶向性以及存在脱靶效应,这就可能导致严重的副作用,进一步限制了给药剂量以及治疗效果;第三:小核酸药物自身携带负电荷,且分子量较高,而细胞膜通常也是带负电荷,由于同种电荷的相互排斥,导致分子很难通过细胞膜进入细胞;第四:内化进入细胞膜中的小核酸药物,又容易被内吞体和酸性溶酶体的微环境,清除出去;这些因素共同导致小核酸药物难以进入细胞核,达到靶基因。
针对这些挑战,科学家们主要通过这几种方法对药物进行改进,第一:通过对寡核苷酸药物的结构修饰,增强药物的酶抗性;第二:通过递送系统,提高药物的靶向性,递送系统又分为两种(化学偶联以及脂质纳米颗粒),这两种方法目前比较成熟,且已有产品上市;第三:通过缓释系统延长药物的半衰期,比如水凝胶、纳米聚合物、微针等;下面将重点介绍持续递送寡核苷酸的方法进行综述。
水凝胶
与脂质纳米递送或化学偶联相比,水凝胶在RNA领域应用还处于早期阶段,水凝胶主要是通过吸收水分溶胀成三维网络,而负载在水凝胶中的RNA可以通过物理化学相互作用直接包裹,也可以将RNA封装于纳米载体后加载至水凝胶中。相比之下,RNA先封装于纳米载体后,RNA的生物活性、释放行为以及特定细胞的靶向性更好。下面是RNA水凝胶的临床前研究时间表以及该技术主要应用的疾病领域。
图 1:最近基于水凝胶的 RNA 递送的临床前研究的时间表(Zhong[1]等, 2023)
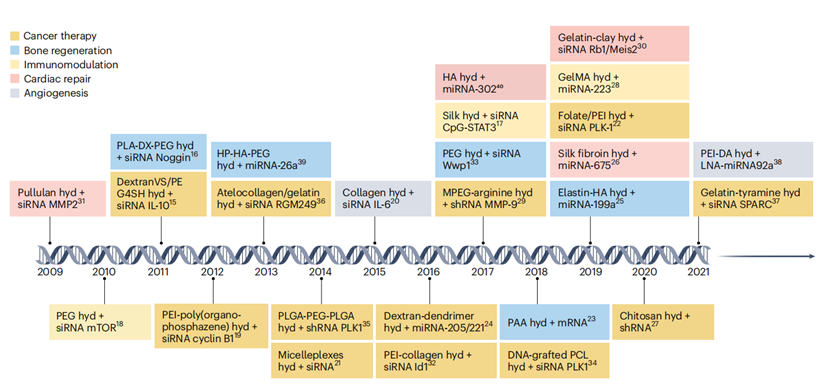
橙色为癌症治疗,蓝色为用于骨再生,黄色为免疫治疗,红色为心脏修复,灰色为血管生成
图2 基于水凝胶的 RNA 递送的生物医学应用(Zhong1 等, 2023)
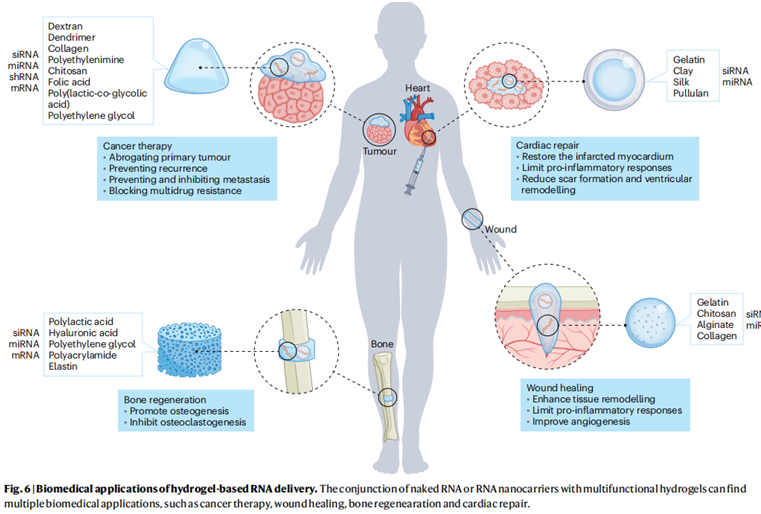
RNA水凝胶分为外用和可注射用水凝胶;外用的水凝胶材料主要有:明胶、壳聚糖、海藻盐、胶原蛋白、聚乙烯醇(PVA)、羟乙基纤维素、聚(N-异丙基丙烯酰胺)(PNIPAM)等材料。然而在早期研究过程中发现,单独采用天然性凝胶材料,药物存在细胞传染性问题,因此后来大多数研究都是采用合成的阳离子聚合物,比如:将阳离子聚乙烯亚胺(PEI)、聚赖氨酸(PLL)等渗入凝胶中,通过带有阳离子的聚乙烯亚胺(PEI)与带有负电荷的siRNA结合,可以延长siRNA的释放、提高药物的传染效果、提高药物的包封率;
注射用的水凝胶材料主要有:经过修饰的环糊精、聚(乙二醇)二丙烯酸酯(PEG-DA)纤维蛋白以及通过化学修饰的一些新型材料。据文献报道[2](Attias Cohen 等, 2022),将反义寡核苷酸与PEI结合,形成纳米复合物,然后将反义寡核苷酸的PEI复合物加载到聚(乙二醇)二丙烯酸酯(PEG-DA)纤维蛋白中,通过紫外照射形成水凝胶微球,肌肉注射后,药物释放时间可以达到21天,对小鼠成肌细胞无毒,将AON负载的PF微球肌肉注射到MDX小鼠的TA肌中,结果显示组织炎症减少,纤维大小的均匀性改善,30天后纤维化减少。
据另一项研究报道3,韩国科技技术研究所制备了一种可注射的具有可裂解酯键的热敏阳离子聚合物-低分子量聚乙烯亚胺聚(有机磷腈)共轭物,该共轭物可以与siRNA形成100nm的多聚物,该多聚物在体温环境下通过疏水作用转为多聚物水凝胶,药物通过该聚合物的溶解和降解从水凝胶中缓慢释放,可以实现长达4周的基因沉默。
图3 水凝胶([3]Kim 等, 2012)
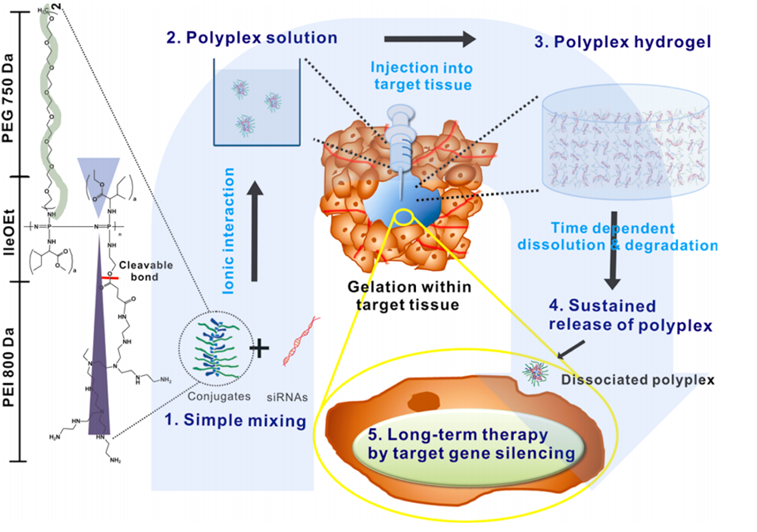
微球
2004年khan等人将寡核苷酸药物包封在微球中,给药后7天寡核苷酸依然在给药部位,聚合物释放的寡核苷酸与游离寡核苷酸有相似的生物分布,大部分集中在肾脏的近曲小管和肝脏,这些发现表明,可生物降解的PLGA微球提供了一种改善寡核苷酸体内递送的方法,根据该篇文献得知,皮下注射封装寡核苷酸药物的微球,在注射部位停留时间较长,而且它的剂量是裸寡核苷药物的一半,但是,该文献年代久远,未见更新的文献,可能其中还存在较多问题待解决;
图4 微球在小鼠体内的([4]Khan 等, 2004)

在2024年,加拿大滑铁卢大学的科研团队将siRNA与PEI结合后形成纳米复合物,然后将siRNA-PEI纳米复合物包裹至PEG-PLGA形成微球,然后再将微球制备成含有聚乙烯醇的凝胶中,用于阴道给药,使得药物在阴道中释放时间可以长达15天以上,并能够显著减少HIV病毒复制高达73%。
纳米球
纳米球是嵌段共聚物的自组装体,具有作为纳米级治疗递送剂的巨大潜力,与脂质体相比,纳米球具有许多优点,例如受控和持续的药物或基因释放、穿透组织的能力和降低的毒性。
图5.纳米聚合物([5]Xiang 等, 2017)
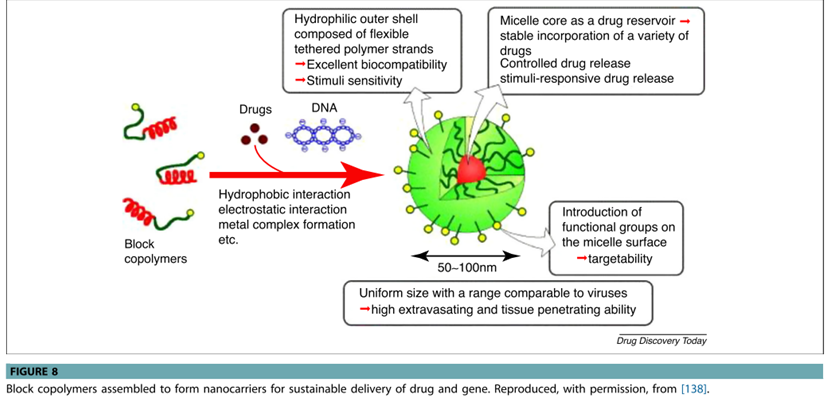
Tabata 及其同事还开发了细胞内 siRNA 持续递送系统,以延长基因抑制的时间,使用丙酮将明胶水溶液与荧光素酶 siRNA 凝聚,然后用戊二醛 (GA) 交联明胶,制备带有 siRNA 的明胶纳米球,为了释放纳米球中的 siRNA,纳米球在含有胶原酶的 PBS 溶液中随时间降解。随着 GA 浓度的增加,纳米球降解速率降低,从而 siRNA 释放速率降低。带有siRNA的纳米球延长了基因抑制的时间,从而实现了siRNA的持续释放。
提到纳米球,我们有必要谈一谈脂质纳米粒,虽然未见相关报道,证明该项技术具有缓释作用,但该项技术具有很好的递送作用,可以有效的降低药物的剂量,因此下面我们来聊一聊脂质纳米粒(LNP)。
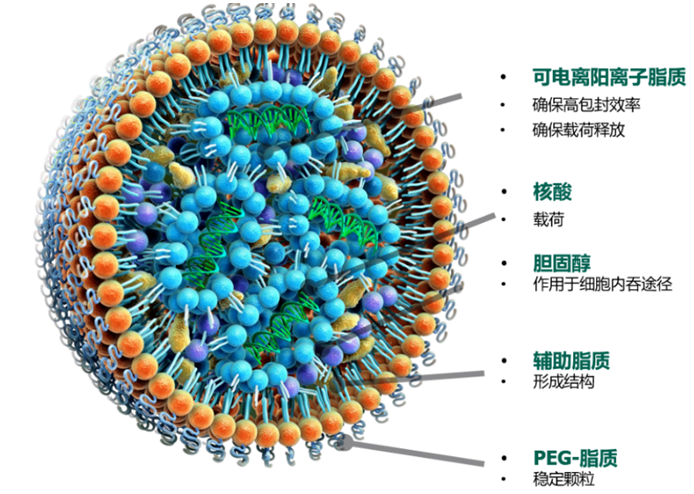
脂质纳米颗粒(LNP)是一种通过对天然和人工脂质材料进行全面筛选,专门为核酸药物递送而优化的脂质体。通常来说,LNP由4种组分构成,包含(1)可电离阳离子脂质、(2)磷脂、(3)胆固醇和(4)聚乙二醇(PEG)脂质。每种成分均决定LNP的稳定性、转染效率和安全性方面起着至关重要的作用;其制备方法如下:将乙醇-脂质混合物与含有寡核苷酸药物的酸性缓冲液(pH 4~5)按一定比例,通过微流控装置进行混合,实现自组装。
组装过程中,可电离阳离子脂质首先被质子化并带正电荷,通过静电吸附作用与带负电荷的核苷酸药物结合。同时,其它辅助脂质包括磷脂、胆固醇、PEG脂质在这之上进一步组装,形成稳定的LNP-mRNA。随后,通过缓冲液交换将mRNA-LNP溶液透析到PBS缓冲液(pH 7.4)中,去除未包封的mRNA、多余的脂质和乙醇,并调整到中性pH,使可电离脂质不带电,在生理pH下更加稳定且毒性更小。
图6 LNP技术的常用辅料[6]
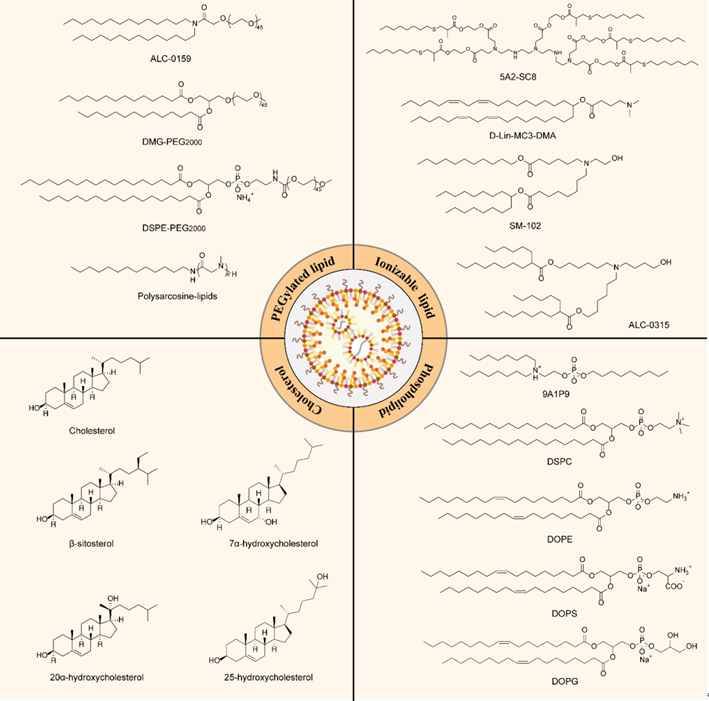
在该处方中,可电离阳离子脂质是LNP的关键成分,其酸解离常数(pKa)决定LNP的电离行为和表明电荷,并进一步影响LNP的稳定性和毒性。磷脂是帮助脂质纳米颗粒自组装和内涵体逃逸的辅助脂质,在临床前研究和临床应用中,常用的磷脂是DSPC和DOPE,胆固醇有助于增加LNPs的稳定性,并帮助细胞膜融合,优化胆固醇的结构也可以提高LNPs的递送效率并赋予LNPs特定的功能。聚乙二醇(PEG)脂质主要作用于减少纳米颗粒聚集,减少单核吞噬细胞吞噬,延长系统循环时间。然而PEG脂质也会阻碍于靶细胞的相互作用和内涵体逃逸,降低转染效率。
LNP的释放机制,根据文献报道,采用LNP-siRNA吸收机制主要是依靠体内的载脂蛋白E(apoE)和低密度脂蛋白(LDL)受体,中性的LNP吸附体内的载脂蛋白E,进而被肝细胞摄取,摄取进入肝细胞后,由于内涵体呈现酸性环境,因此中性的LNP进而变成正电荷,带负电荷的核酸药物从内涵体中逃脱出来,最后到达目的。
ASO应用LNP需要注意的几个点:第一:siRNA和mRNA为双链,而ASO为单链,其结构中的磷酸二脂键主链可能会与LNP相互作用,换句话说,ASO结构中的序列和碱基结构可能会影响LNP的性质,有可能会造成性质不稳,根据文献[7]得知,采用可电离脂质体ssPalmO分别对siRNA,mRNA以及ASO进行包封,两者的组成成分有一定的差异,其中包封siRNA时,其ssPalmO/胆固醇=70:30,而采用该处方包裹ASO发现LNP非常不稳定,LNP容易聚集,为了稳定,该研究团队将处方比例进行修改,处方组成比例修改为ssPalmO/DOPC/胆固醇=40/20/40,并添加1.5%的DMG-PEG2000,ASO浓度为25 nmol/µg。第二,LNP的吸收机制可能同样适用于ASO-LNP;第三,脂质体的稳定性以及粒径也是药物吸收的关键因素。
图7 ssPalmO结构式([7]Tanaka等, 2021)
综上所述,采用持续递送小核酸药物的方法大部分都处于早期阶段,且需要解决药物的细胞传染力,提高药物的包封率,同时还需要借助一些新型材料。
参考文献:
[1]Zhong R, Talebian S, Mendes B B, 等. Hydrogels for RNA delivery[J]. Nature Materials, 2023, 22(7): 818–831.
[2]Attias Cohen S, Simaan-Yameen H, Fuoco C, 等. Injectable hydrogel microspheres for sustained gene delivery of antisense oligonucleotides to restore the expression of dystrophin protein in duchenne muscular dystrophy[J]. European Polymer Journal, 2022, 166: 111038.
[3]Kim Y-M, Park M-R, Song S-C. Injectable Polyplex Hydrogel for Localized and Long-Term Delivery of siRNA[J]. ACS Nano, 2012, 6(7): 5757–5766.
[4]Khan A, Benboubetra M, Sayyed P Z, 等. Sustained Polymeric Delivery of Gene Silencing Antisense ODNs, siRNA, DNAzymes and Ribozymes: In Vitro and In Vivo Studies[J]. Journal of Drug Targeting, 2004, 12(6): 393–404.
[5]Xiang Y, Oo N N L, Lee J P, 等. Recent development of synthetic nonviral systems for sustained gene delivery[J]. Drug Discovery Today, 2017, 22(9): 1318–1335.
[6]Zong Y, Lin Y, Wei T, 等. Lipid Nanoparticle (LNP) Enables mRNA Delivery for Cancer Therapy[J]. Advanced Materials, 2023, 35(51): 2303261.
[7]Tanaka H, Takata N, Sakurai Y, 等. Delivery of Oligonucleotides Using a Self-Degradable Lipid-Like Material[J]. Pharmaceutics, 2021, 13(4): 544.
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论