
单克隆抗体已有40多年的发展历史,自第一个单克隆抗体Orthoclone OKT3获批上市以来,已有众多的单克隆抗体药物在恶性肿瘤、感染性疾病和自身免疫疾病的治疗中发挥了不可估量的重要作用。例如在癌症治疗领域,阿瓦斯汀(贝伐珠单抗,抗VEGF)、赫赛汀(曲妥珠单抗,抗HER2受体拮抗剂)和利妥昔单抗(抗CD20)等这些单抗进入医药市场已经超过15年。
利妥昔单抗批准上市的适应症(部分)
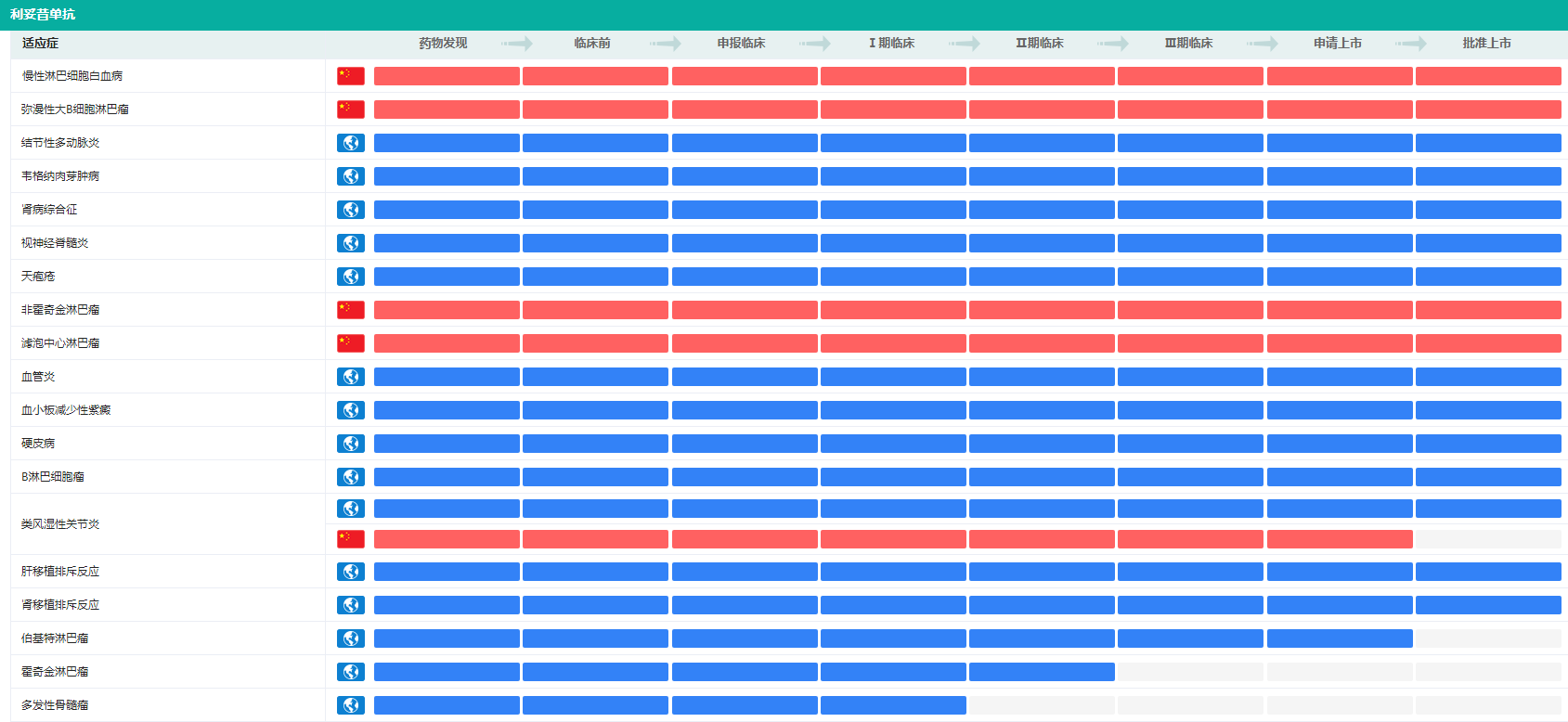
图片来源:药融云全球药物研发数据库
然而,单克隆抗体针对的是单一的靶标,临床有研究表明很多患者不能充分响应单一的疗法,且在治疗T淋巴细胞不能积极参与杀伤肿瘤细胞的情况下,单克隆抗体的治疗也受到了限制,所以结合两种或多种抗原的双特异性抗体应运而生。
2009年4月全球首款双抗药物Removab获批上市,由此开启新药研发世界的另一扇大门。双特异性抗体是一个新兴的研发细分领域,被视为肿瘤治疗的一种新策略,是近些年来最热门的药物研发领域之一。
一、肿瘤治疗新策略——双特异性抗体
双特异性抗体(bispecific antibody,BsAb)是基于抗体技术发展,通过对传统的单抗药物进行改造和修饰,可以同时结合两种不同抗原的工程化抗体,可以通过特有的作用方式,如衔接T细胞和肿瘤、协同抑制信号通路等,发挥单抗药物难以实现的生物学功能。
益于单抗药物良好的疾病疗效和优异的市场表现,双特异性抗体市场快速发展,预计2024年全球双特异性抗体药物市场规模将达到279亿美元。肿瘤仍是研发的主要适应症,全球85%的在研项目集中于此,而中国庞大的肿瘤患者基数为双特异性抗体在中国商业化提供了充足的市场空间,预计2024年中国市场规模将达到50亿元。
据药融云全球药物研发数据库统计,目前全球共有795个双特异性抗体相关项目正在推进中,9款双特异性抗体已经批准上市,其中4款已经上市的药物与CD3靶点相关。CD3靶点可谓占据双抗市场的“半壁江山”。
全球批准上市的双特异性抗体(部分)

图片来源:药融云全球药物研发数据库
二、占据双抗市场“半壁江山”——CD3靶点
CD3分子是T细胞表面的通用标志物,是由6条肽链以非共价键组成的蛋白复合物结构,由CD3γ、CD3δ、CD3ε、CD3ζ,CD3ε四条恒定链组成。CD3γ、CD3δ、CD3ζ分别由CD3E、CD3G、CD3D、CD3Z基因编码,位于人23号染色体上。
T淋巴细胞活化是免疫应答的基础,T淋巴细胞活化需要双信号的刺激。第一信号为特异性抗原识别信号,即抗原呈递细胞(APC)表面的MHC-抗原肽复合物和TCR-CD3复合物结合,将刺激信号传入细胞内,第二信号为协同刺激信号,即APC表面协同刺激分子和T细胞表面系统刺激分子如CD8等结合。
CD3靶点通路图(适应症:Depression、Cachexia、Lipodystrophy)
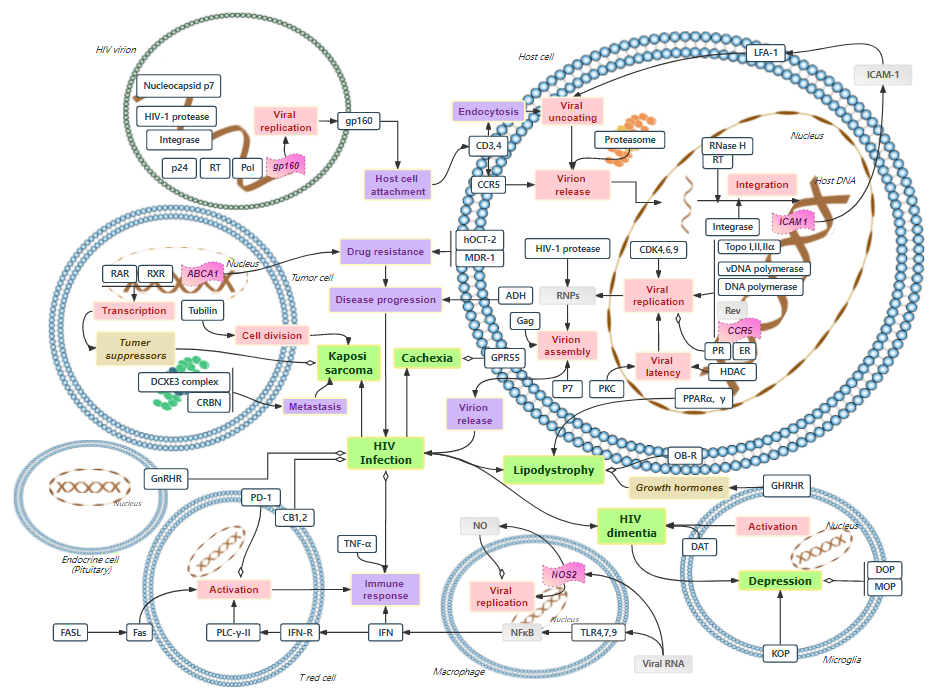
图片来源:药融云靶点格局数据库
CD3标记胸腺细胞、T淋巴细胞及T细胞淋巴瘤,其胞质段含免疫受体酪氨酸活化基序(Immunoreceptor tyrosine-based activation motif,ITAM),TCR识别并结合由MHC分子提呈的抗原肽,导致CD3的ITAM的保守序列的酪氨酸残基被T细胞内的酪氨酸蛋白激酶p56lck磷酸化,然后可募集其他含有SH2(Scrhomology2)结构域的酪氨酸蛋白激酶(如ZAP-70)。ITAM的磷酸化和与ZAP-70的结合是T细胞活化信号传导过程早期阶段的重要生化反应之一。
CD3分子具有稳定TCR结构和传递活化信号的作用,即TCR以非共价键与CD3结合,形成TCR-CD3复合物,通过识别并结合MHC呈递的抗原从而激活T细胞,促进T细胞的分裂与分化。因此,针对CD3分子的单克隆抗体能够激发或阻断T细胞活化信号转导,清除效应T细胞或诱导调节T细胞的产生,从而为治疗器官移植排斥和自身免疫性疾病提供了新的思路。
CD3靶点层级关系

图片来源:药融云靶点格局数据库
1986年第一个被FDA批准上市的单抗药物就是CD3的莫罗单抗(Muromonab),用于治疗器官移植后的急性排斥反应。CD3单抗也可应用于治疗克罗恩病,溃疡性结肠炎和Ⅰ型糖尿病等。
CD3分子是T细胞表面的通用标志物。因此,靶向CD3分子的双特异性抗体吸引、招募T细胞至肿瘤细胞周围并激活T细胞发挥肿瘤杀伤作用,这类抗体被称为T细胞衔接器(T cell-engaging BsAb,TCE双抗)。
目前处于临床阶段的双特异性抗体中,有约40%的候选物靶向CD3抗原,因此TCE双抗的开发是双特异性抗体领域的主流热点。基于相同的原理,靶向CD3分子在T细胞受体(TCR-T)疗法中也同样应用。
三、全球CD3靶点相关药物研发现状
据药融云数据库统计,目前全球共有333个CD3相关项目正在推进中,其中I期临床75个,II期临床55个,III期临床4个,涉及169家企业。全球CD3靶点相关已批准上市药物共计8个,其中单抗药物3个,双特异性抗体药物4个,T细胞受体(TCR-T)疗法1个。
全球CD3靶点已批准上市药物
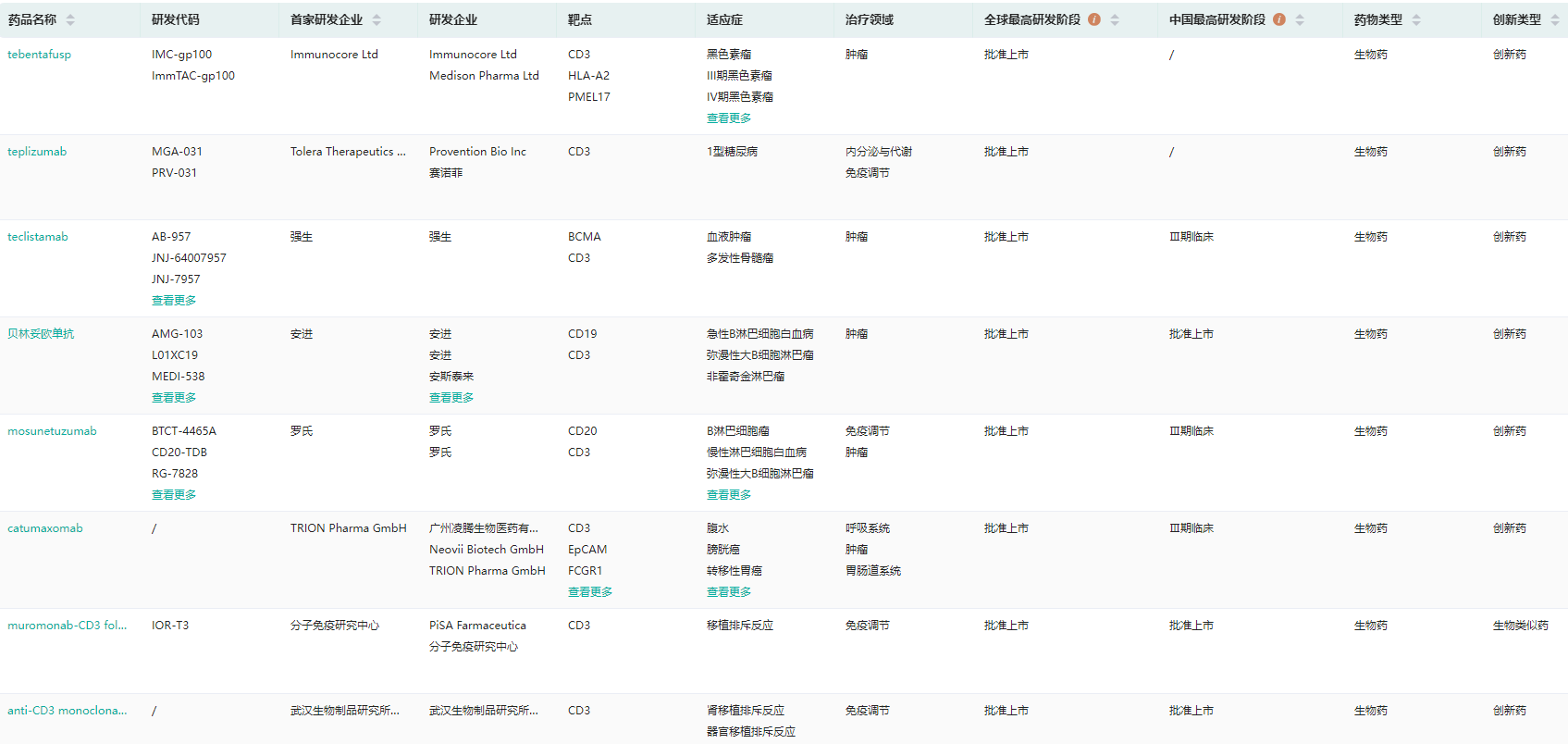
图片来源:药融云全球药物研发数据库
单抗方面,最新上市的CD3单抗药物为FDA于2022年11月17日批准上市teplizumab,用于患有2期1型糖尿病≥8岁的儿童及成人患者,以延迟3期1型糖尿病的发病。
Teplizumab主要通过与效应T细胞表面的CD3结合,抑制其对胰岛β-细胞的攻击,从而降低对胰岛β-细胞的破坏作用,延缓1型糖尿病发作。Teplizumab是首个上市也是唯一针对Ⅰ型糖尿病的免疫调节疗法,这是自100年前发现胰岛素以来对1型糖尿病病症的最大的治疗突破。
双抗药物方面,已上市的药物分别为TRION Pharma研发的卡妥索单抗catumaxomab(CD3×EpCAM)、安进研发的贝林妥欧单抗blinatumomab(CD3×CD19)、罗氏研发的mosunetuzumab(CD3×CD20)、强生研发的teclistamab(CD3×BCMA)。
TRIONPharma研发的catumaxomab于2009年上市用于治疗恶性腹水,由于价格昂贵和适应症的选择不当,上市后沦为“一种昂贵的辅助用药”,最终于2014年停止于市场销售并于2017年6月宣布退市。
catumaxomab化学结构
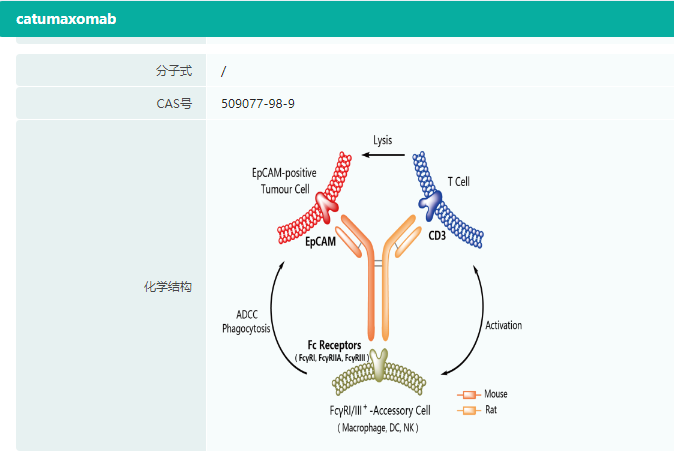
图片来源:药融云全球药物研发数据库
目前凌腾医药在亚太地区持续开发卡妥索单抗,11月16日卡妥索单抗临床试验最新结果公布,显示在非肌层浸润性膀胱癌中具有良好的安全性和初步疗效。
贝林妥欧单抗于2014年获FDA批准上市用于治疗急性B淋巴细胞白血病,贝林妥欧单抗于2020年获中国国家药品监督管理局(NMPA)批准,用于治疗成人复发性/难治性前体B细胞急性淋巴细胞白血病。
2022年6月,罗氏旗下基因泰克mosunetuzumab获得欧盟有条件上市,用于治疗先前至少接受过两次系统治疗的复发性/难治性滤泡性淋巴瘤(FL)成年患者。2022年8月,强生旗下杨森制药teclistamab获批上市,用于治疗复发和难治性多发性骨髓瘤(RRMM)成年患者。
T细胞受体疗法方面,2022年1月26日,Immunocore宣布,美国FDA已批准其创新疗法Kimmtrak(tebentafusp-tebn)上市,治疗特定的葡萄膜黑色素瘤,这是全球首款获批的T细胞受体疗法。
Kimmtrak药品基本信息

图片来源:药融云美国FDA批准药品数据库
四、国内CD3靶点双抗赛道进展激烈
据药融云数据库统计,目前全球正在推进的CD3相关项目普遍以CD3双/多特异性抗体项目为主,达269个,其中双特异性抗体项目占比更是高达73%。
从国内研发进展来看,国内共有包括恒瑞医药、君实生物、齐鲁制药、康诺亚生物、百利药业、步长制药、百济神州等在内的36家企业参与该靶点相关药物研发,涉及在研项目56个,在全球在研项目中占比达21%。
国内企业在双/多特异性抗体项目中表现出较高的参与度,在研项目中双/多特异性抗体项目占比超90%。目前国内双抗新药的研发已经爆发,预计国内双抗有望在两年内迎来一波上市潮,并开始进入商业竞争阶段。
国内CD3靶点相关药物研发现状(部分)
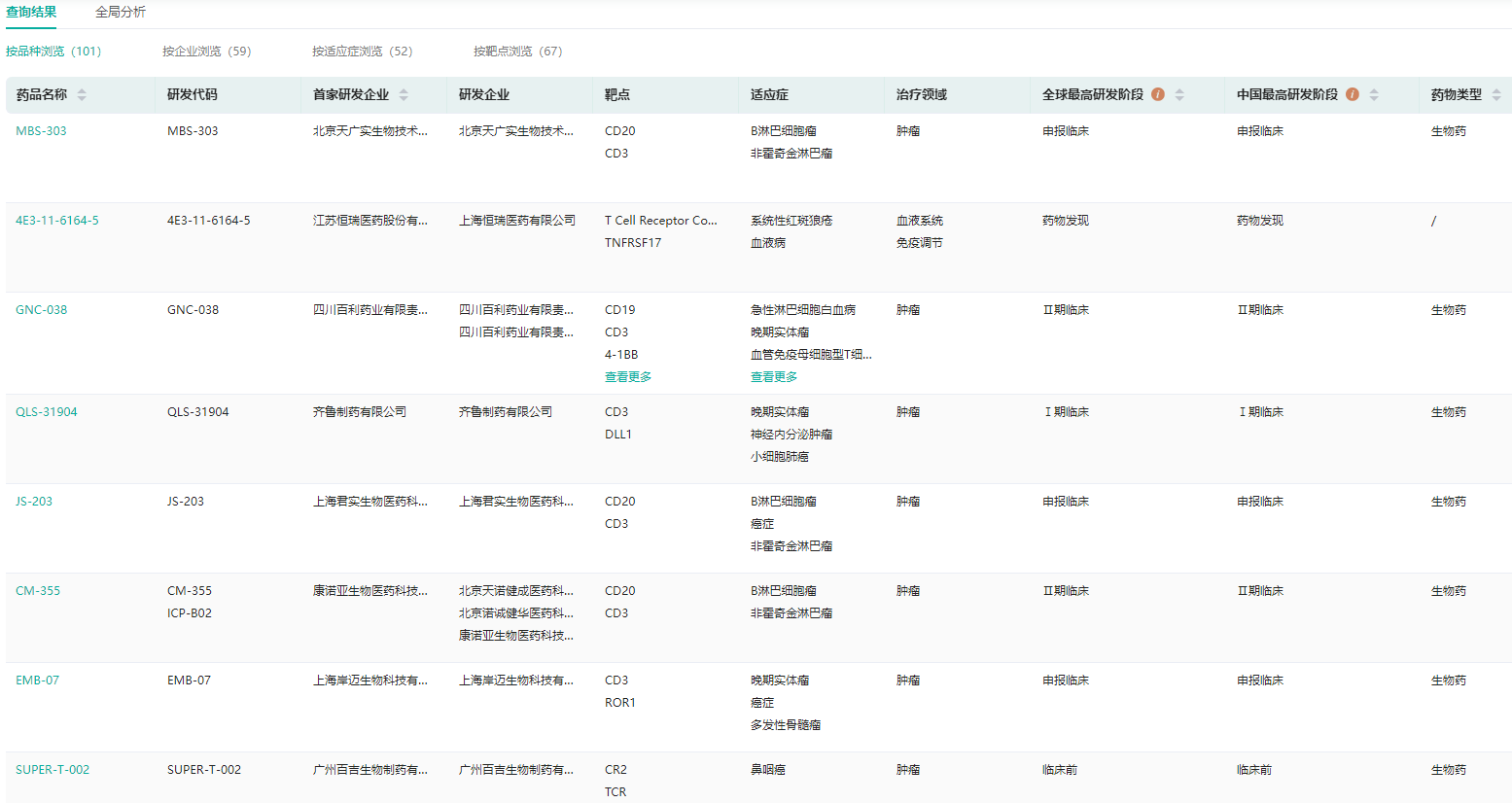
图片来源:药融云全球药物研发数据库
占据了全球双抗研发的半壁江山的CD3双抗,目前在血液瘤方面进展较快,具有良好应用前景,实体瘤方面进展较慢。因为与血液瘤不同,实体瘤中的靶点除了在肿瘤上表达外,还在正常组织中表达。
在治疗过程中,抗体会将T细胞导向正常组织中,从而使得这些组织被T细胞攻击并造成不可逆的损伤。同时,实体瘤的肿瘤微环境(TME)对于CD3靶点的药物影响较大。药物分子与CD3亲和力过强的话,也会导致免疫T细胞过度激活,诱发细胞因子释放综合症(CRS)。
随着相关研究的深入,未来该靶点安全性问题是否能得到解决,实体瘤方面有效性能否获得进展,新靶点组合能否研发全新药物?让我们拭目以待。
想要了解更多靶点/创新药专题报告,欢迎持续关注《药融云全球在研新药与靶点月报》,内容覆盖国内外创新药研发进展、申报进度、国际化等最新情报,获取完整报告内容,可关注“药融云”公众号(yrydata),后台回复“报告”关键词即可进行领取。
想要解锁更多药物靶点信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握各药物靶点药物基本信息、上市药物情况、销售情况与各维度分析、药企药物研发进展、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论