
新冠疫情阴霾仍未散去,在此GA次行业回落大潮中,上市的生物技术公司通过公开发行股票的方式筹集资金成为一种越来越常见的策略和手段。
Biohaven曾通过公开募股筹集了约3亿美元。Cerevel在8月份筹集了2.5亿美元的资金,该公司最近决定在未来几年通过公开募股出售价值高达9亿美元的股票。而最新的例子要数11月30日宣布出售部分股票筹集3亿美元的基因编辑公司Intellia和眼科新药公司Iveric Bio。
Iveric Bio公司正在为其治疗晚期AMD继发的地图样萎缩适应症的候选药物向FDA提交申请。今年9月,Iveric在芝加哥举行的眼科会议上公布了其药物的亚组数据。11月初,它提交了avacincaptad pegol的NDA的第一部分,这是一种补体C5蛋白抑制剂。在这个领域,Iveric公司稍有点落后于Apellis公司,后者也在开发一种地理萎缩的治疗方法,尽管FDA最近把对Apellis公司药物的决定期限推到了2023年2月,该决定最初定于2022年11月26日作出。
据悉,近期Iveric以每股22.5美元的价格出售了1330万股普通股,筹集了3.04亿美元。Iveric公司给了承销商一个选择权,以这个价格再买200万股。Iveric在一份SEC文件中称这笔钱将“用于准备并在监管部门批准的情况下,在美国GA推出avacincaptad pegol的潜在商业化,包括销售队伍的雇佣和相关费用,以及用于营运资金和其他一般企业用途。”
公司简介

Iveric Bio, Inc.(Nasdaq: ISEE)是一家以科学为导向的生物制药公司,专注于发现和开发具有重大未满足医疗需求的视网膜疾病的新型疗法,该公司正在开发针对与年龄有关的视网膜疾病的治疗药物候选产品,以及针对孤儿遗传性视网膜疾病或IRD的基因治疗产品候选药物。
Iveric Bio公司基本信息(部分)
截图来源:药融云医药投融资数据库
公司成立于2007年1月5日,在美国特拉华州注册,于2013年9月上市交易(截至2022年12月20日,Iveric Bio市值约$30.26亿)。截至2022年1月31日,Iveric Bio拥有94名全职员工,有67人从事研发、制造和质量控制与保证。
Iveric Bio已向FDA提交Zimura第一部分的滚动式审查
2022年11月3日,Iveric Bio宣布已向FDA提交avacincaptad pegol (ACP,也称为Zimura)新药申请(NDA)的第一部分“滚动式审查”(rolling review),公司有望在今年年底前完成新药申请的最后部分。这是全球第2款申报上市的GA疗法,也是全球第4款申报上市的补体C5靶向疗法。
avacincaptad pegol药物基本信息
截图来源:药融云全球药物研发数据库
- 关于滚动式审查(rolling review)
在相关地区药品监督管理/医疗卫生部门当时允许邀请采取所谓滚动式审查时,厂商可将资料分批送审,管理部门立即逐批审查数据,而不需要等待全部数据收集完毕后再开展审核,一旦证实产品安全、疗效及品质无疑,即可核准。
- 关于GATHER临床试验
GATHER1与GATHER2是ACP基于关键的临床试验项目,在12个月的时间点上均达到了减缓GA进展的主要目标,并具有统计学意义,该公司要求滚动提交其计划的NDA,FDA随后批准了该申请。根据公司与FDA的协议,NDA的第一部分,将包括完整的ACP临床数据包,相关数据已在2022年11月3日早些时间完成了提交工作。
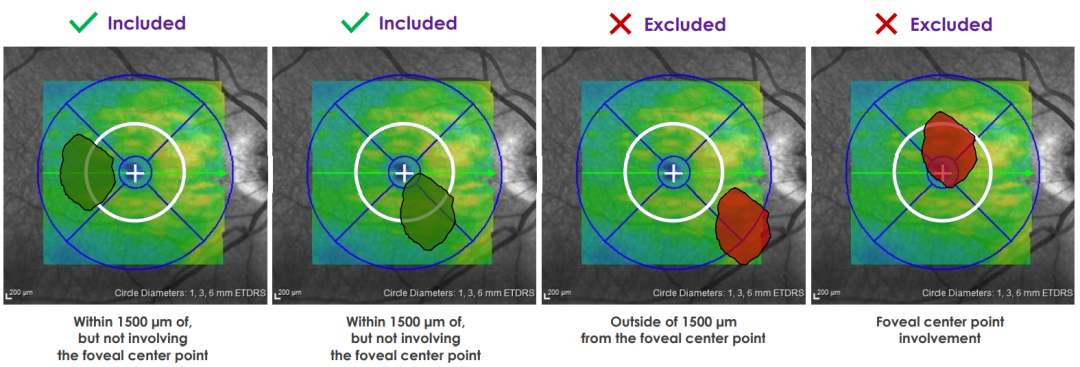
GA必须是在1500µm范围内的部分,但不涉及中心点
该公司此前报道,ACP在其已完成的随机、双掩模、假药对照、多中心GATHER1临床试验和正在进行的GATHER2临床试验中达到了主要终点,这两项试验均为3期随机、双掩模、假药对照、多中心临床试验。这些临床试验测量了每月2mg ACP玻璃体内给药对继发于AMD的GA患者的有效性和安全性。在这两项试验的前12个月,患者被随机分为每月接受ACP2mg或安慰剂。GATHER1有286名参与者,GATHER2有448名参与者。两项关键研究的主要疗效终点均基于三个时间点(基线、第6个月和第12个月)通过眼底自身荧光测定的GA面积。使用观察数据,从基线到第12个月GA区域的平均增长率(斜率)在GATHER 1为35%,在GATHER2为18%。在GATHER1和GATHER2联合研究中,2mg剂量中最常报告的治疗紧急不良事件与注射手术有关。
在接受avacincaptad pegol 2mg的患者中,最常见的不良反应(≥5%,大于假反应)是结膜出血(13%),眼压增加(9%)和CNV(7%)。经过18个月的GATHER1治疗和12个月的GATHER2治疗,没有发生严重的眼内炎症、血管炎或眼内炎事件。
- 关于Zimura
Zimura是一种旨在抑制补体C5蛋白的聚乙二醇化RNA适配体,最早由Archemix开发。据药融云数据库显示,2007年7月底,Iveric与Archemix达成许可协议,获得Zimura作为眼科药物的全球开发和商业化权益,预计支付总金额八千七百万美元。研究人员认为,补体系统和C5蛋白的过度激活在与AMD继发GA相关的瘢痕和视力丧失的发生发展中起关键作用。通过阻断C5蛋白的活性,Zimura可能会降低导致视网膜细胞退化的补体系统的活性,并可能减缓GA的进展。该产品于2020年4月获FDA授予快速通道资格。
Archemix与Iveri关于Zimura的交易信息(部分)
截图来源:药融云全球医药交易数据库
avacincaptad pegol是一种新型C5补体抑制剂,用于治疗继发于年龄相关性黄斑变性(AMD)及Stargardt病(SMD)的地理萎缩(GA)。正如之前宣布的,该公司获得了FDA的ACP快速通道指定。在收集到试验项目GATHER2数据后,该公司及时与FDA分享了数据。

Zimura的作用机制
avacincaptad pegol被FDA授予突破性疗法称号
2022年11月17日,IVERIC宣布FDA已授予avacincaptad pegol(ACP,又称Zimura®)突破性疗法称号,这是一种新型的补体C5抑制剂,用于治疗老年性黄斑变性继发的地理性萎缩(GA)。迄今为止,ACP是第一个也是唯一一个获得GA突破性疗法认定的研究性疗法,该认定是基于GATHER1和GATHER2关键临床试验中12个月的预设主要终点数据。
Iveric Bio首席执行官Glenn P. Sblendorio说:“这一突破性指定反映了GATHER1和GATHER2都达到了其主要终点,其安全性符合所要求的严格标准。我们现在专注于执行我们完整的NDA提交和上市准备工作,并有可能成为该领域第一个上市的公司。我们期待着与FDA合作,加快avacincaptad pegol的审查时间,使之有可能为受GA影响的AMD患者带来一种新的疗法。”
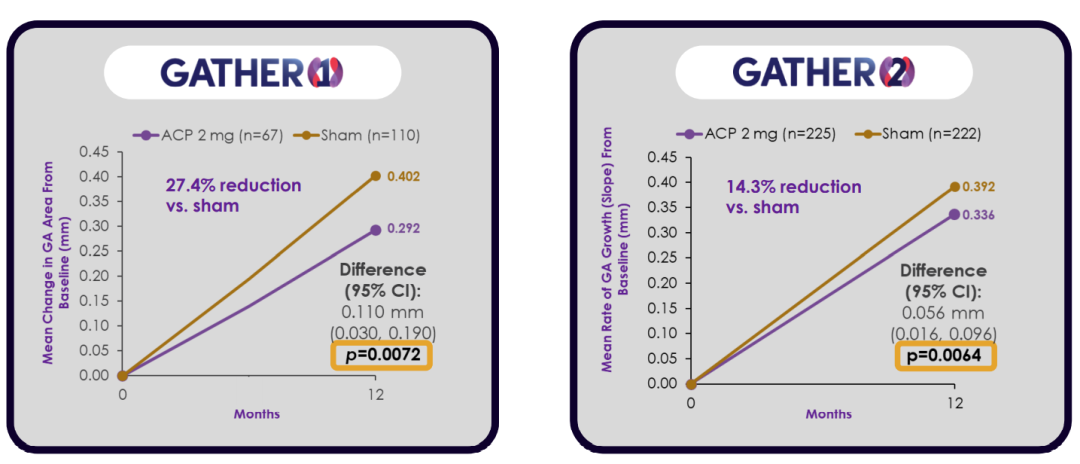
GATHER1& GATHER 2研究的主要终点结果
此突破性疗法决定是基于GATHER1和GATHER2关键研究的12个月主要疗效终点数据,这些研究评估了ACP对位于临床眼窝内和/或外的GA患者的安全性和疗效。根据GATHER2的特殊方案评估(SPA)协议,FDA要求提供GA面积从基线到第12个月的平均增长率(斜率)。这些结果显示,与假药相比,使用观察(非转换)数据,治疗差异明显,分别为35%(p=0.0050;GATHER1)和18%(p=0.0039,GATHER2);使用平方根转换,分别为28%(p=0.0063;GATHER1)和14%(p= 0.0064;GATHER2)。在GATHER1和GATHER2中,没有发生严重的眼内炎症、血管炎或眼内炎。
- 关于突破性疗法的指定
突破性疗法的指定传达了FDA对高效药物开发计划的更深入指导,涉及高级管理人员的组织承诺,以及滚动审查和优先审查的资格。FDA将审查为支持批准被指定为突破性疗法的药物而提交的全部数据,以确定这些药物在被批准上市前对其预期用途是否安全和有效。
产品研发管线
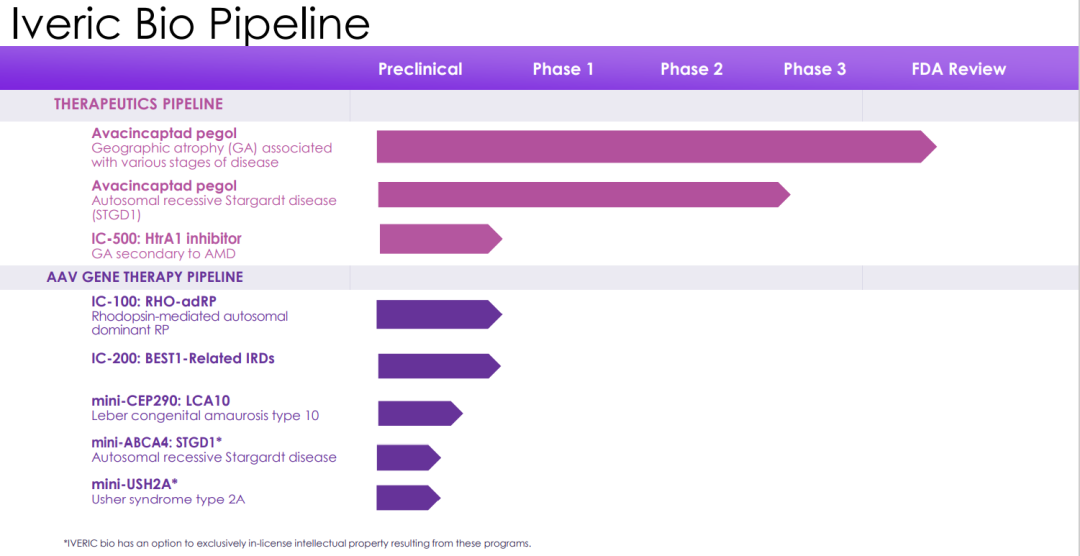
Iveric Bio研发管线(更新至2022年11月28日)
财务表现
一、2022年第三季度财务报告
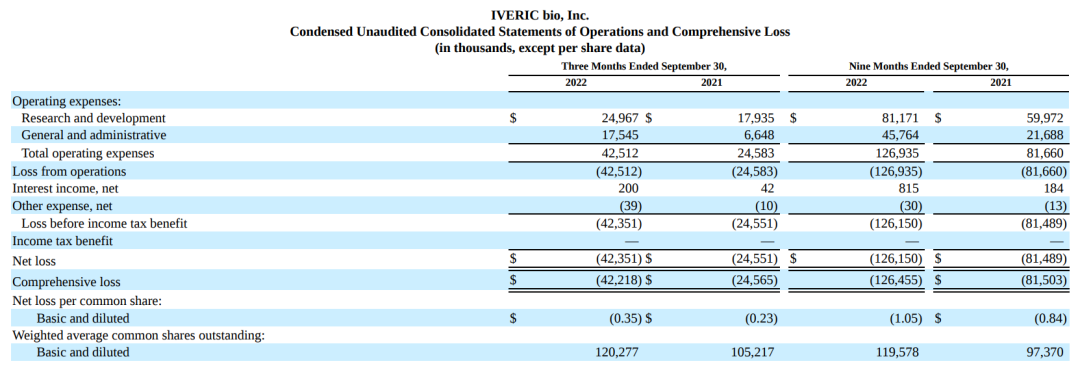
该公司2022年第三季度季度报告净亏损$4240万,2021年同期净亏损$2460万。在截至2022年9月30日的9个月中,该公司报告净亏损$1.262亿。
截至2022年9月30日,该公司拥有$3.21亿的现金、现金等价物和可供出售证券,这反映了其与Hercules和SVB的定期贷款债务融资工具下的$5000万初始借款的影响。该公司预计其2022年年底的现金、现金等价物和可供出售证券将在$2.65亿~$2.75亿,至少能维持到2024年年中的正常运营。
2022年第三季度公司研发支出为$2500万,2021年同期为$1790万。截至2022年9月30日的9个月,研发费用为$8120万,2021年同期为$6000万。研究和开发费用的增加主要是由于公司GATHER2试验的持续进展、ACP制造活动的增加以及人员成本的增加,包括增加研究和开发人员相关的基于股份的薪酬,但被与公司基因治疗计划相关的成本下降所抵消。
二、2022年半年度报告
2022年第二季度该公司净亏损$4930万,而2021年同期净亏损为$3010万。截至2022年6月30日的六个月,该公司报告净亏损$8380万或每股摊薄($0.70),而2021年同期的净亏损为$5690万或($0.61)。
该公司2022年第二季度的研发费用为$3360万,而2021年同期为$2350万。截至2022年6月30日的六个月,研发费用为$5620万,而2021年同期为$4200万。研发费用增加主要是由于Gather2试验的持续进展、Zimura项目费用以及人员成本的增加,包括与额外研发人员相关的基于股票的薪酬,由与IC-100和IC-200相关的成本减少所抵消。
三、2021年年度报告
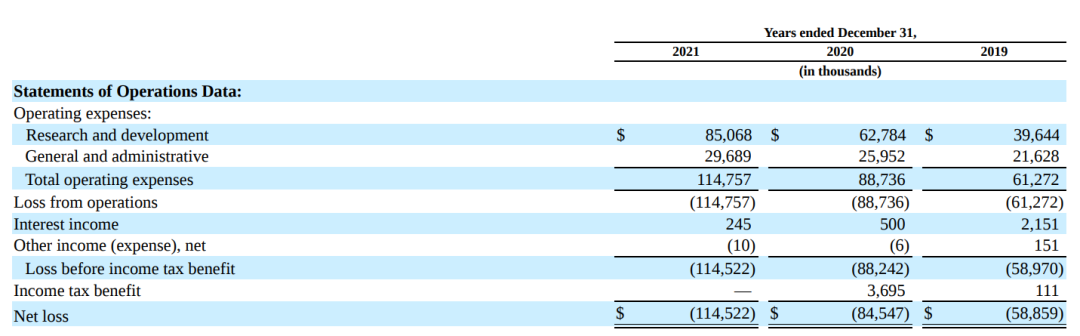
由于Iveric Bio没有产品被批准销售,故不会收到与产品相关的任何收入。2021年全年该公司净亏损$1.15亿,而2020年这一数据为$8454.7万。截至2021年12月31日,该公司现金、现金等价物和可供出售证券总额为$3.82亿,没有债务。
2021年Iveric Bio的研发费用为$8510万,与截至2020年的$6280万相比,增加了$2230万。2021年研发费用增加主要是由于与Zimura相关的成本增加了$2480万,人员成本增加了$780万。Zimura的成本增加主要是由于Gather2试验患者登记的开始和完成以及生产活动的增加。IC-100和IC-200的成本下降主要反映了生产和临床前开发活动的减少。一般和管理费用的增加主要是由于人员成本的增加,包括基于股份的补偿成本,以及外部成本的增加,包括与诉讼相关的法律和咨询成本。
近三年相关项目研发费用明细:
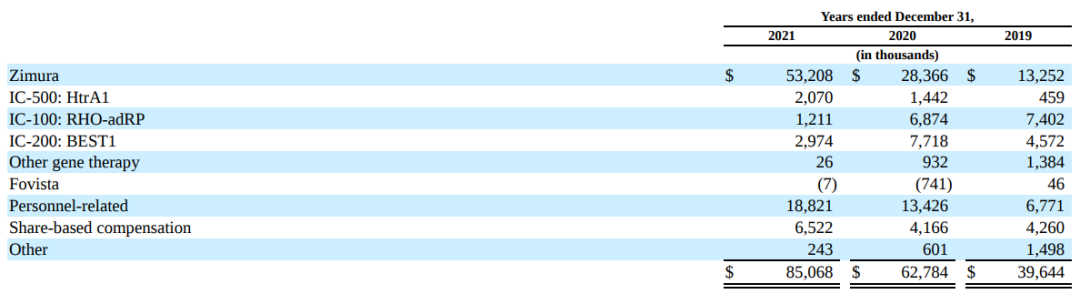
眼部疾病地图样萎缩(GA):目前没有获批疗法
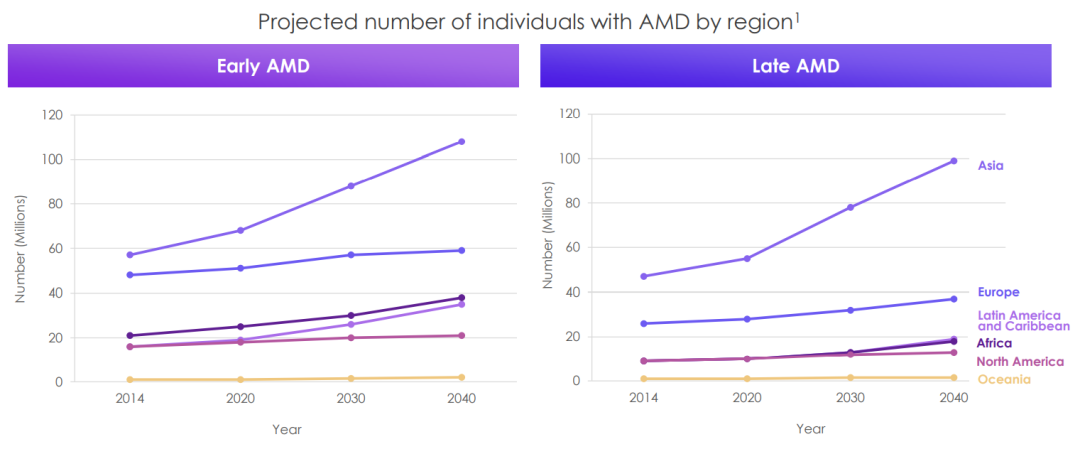
年龄相关性黄斑变性(AMD)为常见的黄斑区病变,是老年人群致盲的首要原因,不及时治疗可导致永久性视力丧失。全球每年大约有1400万人因AMD出现严重视力障碍或失明。AMD分为早期和晚期2个阶段,早期患者往往没有任何临床症状,晚期则发生中重度视觉障碍。
临床上,晚期AMD的定义包括2个主要特征:新的脉络膜血管生长未突破或突破视网膜色素上皮(RPE)进入神经视网膜,称为“脉络膜新血管形成(CNV)”;或RPE进行性萎缩,称为“地图样萎缩(GA)”。GA也被称作“干性”AMD,CNV被称作“湿性”或“渗出性”AMD。GA和CNV不存在互斥,可以在同一只眼中合并出现。目前对于AMD患者GA和CNV合并存在的了解较少。
GA是双侧不可逆的严重功能性视力丧失的重要原因。许多GA患者即使中心视力保持正常,也会在视野中出现暗点(称为暗点)。因此,GA对受影响个体的功能性视觉、生活质量和独立性有重大影响。从诊断时起,中央GA发展的中位时间为两年半,预计在大约七年内在另一只眼睛中发展。根据2004年发表在《眼科学文献》(Archives of Ophthalmology)上的一项综合流行病学研究,美国目前约有150万人患有GA。
此外,根据2015年发表在《美国眼科杂志》(American Journal of Ophthalmology)上的一项研究,美国每年约有15.9万人患有GA。虽然抗VEGF疗法可用于治疗湿性AMD,但目前没有FDA或欧洲药品管理局(EMA)批准的治疗方法可用于GA。GA和许多其他阶段的AMD(包括中期AMD)缺乏治疗选择,这是一个迫切的医疗需求未得到满足的领域,也是不断扩大的老年人口的主要公共卫生问题。
预计AMD在全球的患病率将会上升
结语
眼部疾病可由多种因素引起,在严重的情况下,眼疾还会导致视力完全丧失。可导致视力完全丧失的最常见眼病是影响视网膜和视神经的疾病,包括老年黄斑变性(AMD)、糖尿病视网膜病变和青光眼。另外,还有许多其他不太常见但仍代表未满足的医疗需求的眼病,特别是与单基因突变(称为单基因)相关的孤儿IRD,其通常在年轻患者中导致视网膜变性和视力丧失。以上领域不仅是潜在的市场机会,同时,作为越来越令人棘手的疾病难题之一,眼疾也亟待眼科药物开发者的探索和查究。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
https://investors.ivericbio.com/;
https://investors.ivericbio.com/financial-information;
https://endpts.com/intellia-and-iveric-sell-stocks-to-raise-money-each-netting-300m/;
https://mp.weixin.qq.com/s/fHj2vRKEu-Pe3uZCTu_43A;
https://investors.ivericbio.com/static-files/212c1e31-b51a-4fba-bf53-085b483eb0a3;
https://mp.weixin.qq.com/s/Z15yBzk4Vi2KEEKDcPw5Rg;
周海生,苏畅,刘磊,巩慧《地图样萎缩和脉络膜新生血管并存的黄斑变性研究进展》Journal of Clinical Medicine in Practice;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发信息、仿制药布局情况、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论