
引言
目前,三阴性乳腺癌(TNBC)的免疫治疗以K药(Keytruda)和T药(Tecentriq)为首的PD-1免疫检查点抑制剂为主,但是其存在总体反应率有限、缺少疗效预测指标等局限性,这表明其可能存在未知的免疫逃逸机制。
最近,复旦大学上海医学院的一项研究首次发现了三阴性乳腺癌可能的免疫逃逸机制——Lgals2(半乳糖结合凝集素2),并指出其可能是潜在的免疫治疗靶点,相关文章于6月30日发表在science advances上。

研究内容
研究利用体内CRISPR筛选和转录组的分析,确定了Lgals2是三阴性乳腺癌中涉及免疫逃逸的候选调节因子,揭示了其初步作用机制。
研究人员先是利用CRISPR筛选技术确定了目标基因—Lgals2。而后发现Lgals2在体内影响肿瘤生长,而不是在体外,这表明其可能依赖肿瘤微环境来影响肿瘤细胞的增殖。
通过体外增殖试验和体内增殖试验,发现Lgals2在体外肿瘤增殖中没有先天功能(P > 0.05)。相比之下,过表达Lgals2的肿瘤在体内生长明显更快(P < 0.01)。
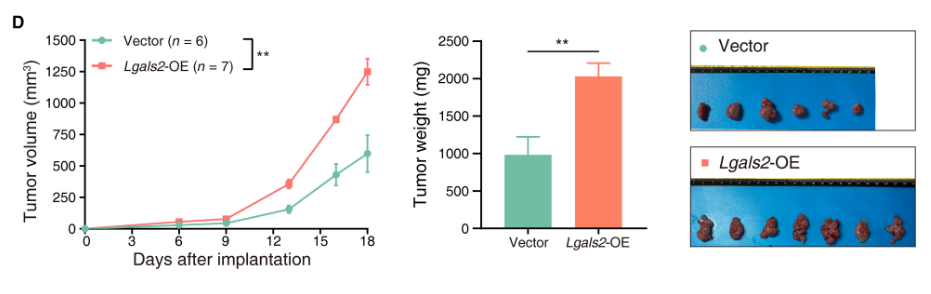
而后,研究人员进行了进一步的验证,通过流式细胞术确定了其确实与免疫细胞浸润有关,通过单细胞RNA-seq 揭示了TME 中Lgals2诱导的巨噬细胞极化,最终确认了Lgals2的作用机制。
肿瘤细胞固有的Lgals2诱导肿瘤相关巨噬细胞数量的增加,其通过调控集落刺激因子1及其受体轴(CSF1/CSF1R),诱导巨噬细胞的M2样极化(具有抗炎及促肿瘤作用)和肿瘤微环境的浸润增加,从而在体内促进TNBC肿瘤微环境中的免疫抑制性质。
结果分析
研究发现,不管是通过使用CSF1R拮抗剂pexidartinib(PLX3397)阻断LGALS2所调控的CSF1/CSF1R轴,还是利用llama-derived的抑制性抗体阻断LGALS2成功地阻止了肿瘤生长并逆转了免疫抑制。
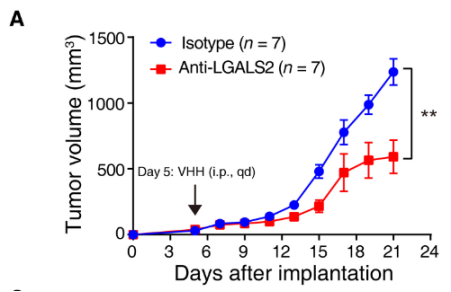
与使用同型种(起阴性对照作用)抗体的小鼠相比,使用LGALS2阻断抗体的小鼠肿瘤体积明显下降
小结
作为一个新发现的靶点,Lgals2的研究还不够成熟,比如Lgals2对的免疫逃逸研究目前主要集中在巨噬细胞上,并且仅针对三阴性乳腺癌,研究中使用的药物还在药物发现期,其安全性和靶向性还需进一步的优化。
目前复旦大学的团队已经在探索Lgals2是否可以直接影响TME中其他免疫细胞的活性,其初步药物试验也验证了其作为药物治疗靶点的潜力。研究人员认为,此项研究结果对重新审视肿瘤细胞和免疫系统的相互作用具有直接意义,有必要进一步探索Lgals2对其他癌症的影响。
参考来源:
[1] In vivo multidimensional CRISPR screens identify Lgals2 as an immunotherapy target in triple-negative breast cancer
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论