
一、本周国内创新药/改良型新药注册申报分析
根据药融云数据统计,2022.06.13-2022.06.19期间共有61项创新药/改良型新药注册申请获CDE承办(按受理号统计,不含补充申请)。其中,国产药品受理号38个,进口药品受理号23个。本周共计37款创新药/改良型新药临床试验申请获得“默示许可”。 其中值得关注的有:
- CGT-1881片
公开资料显示,CGT-1881片是一款高效、高选择性的新一代CXCR4拮抗剂,适用于非霍奇金淋巴瘤(NHL)或多发性骨髓瘤(MM)患者动员造血干细胞进入外周血,以便完成造血干细胞的采集与自体移植。当前,作用于CXCR4的拮抗剂全球还没有口服药物获批。
- CGT-9475片
CGT-9475片是新一代ALK抑制剂,用于已有ALK抑制剂耐药后的后续治疗。CGT-9475针对非小细胞肺癌细胞系中L1196M、RET等耐药突变具有显著抑制作用,在临床前研究也展示出良好的血脑屏障穿透效果,优质化的解决NSCLC治疗中耐药性和脑转移的两大临床痛点。
- WJ13404片
由君实生物与微境生物合作开发的原创的第四代EGFR(表皮生长因子受体)抑制剂WJ13404片(项目代号“JS113”拟用于EGFR突变非小细胞肺癌和其他实体瘤的治疗。公开资料显示,目前已上市的EGFR抑制剂有三代,而JS113作为第四代EGFR抑制剂具有全新的分子骨架和独特的生物活性,对第三代EGFR抑制剂不敏感的原发性和获得性EGFR突变(包括 Del19/T790M/C797S和 L858R/T790M/C797S共突变),以及部分TKI耐药的旁路激活靶点和免疫抑制性靶点都有很好的抑制活性,同时对野生型EGFR具有高度选择性。
- TQC2938
正大天晴自主研发的1类新药TQC2938是一种针对ST2(白细胞介素-33(IL-33)受体)的人源化IgG2单克隆抗体,用于治疗中重度哮喘。公开资料显示,TQC2938可以特异性结合人ST2,阻断其与IL-33配体的相互作用,阻断ST2/IL-33信号通路,减少下游Th2细胞因子(IL-4、IL-5、IL-13等)的产生,降低嗜酸性粒细胞等炎性细胞的水平,最终减少哮喘发生。
- RC98
6月14日国家药品监督管理局审评中心(CDE)官网公示:荣昌生物的RC98获批临床,联合维迪西妥单抗治疗实体瘤。公开资料显示,维迪西妥单抗和RC98均为荣昌生物自主研发的新药。维迪西妥单抗是我国首个获批上市的原创性ADC(抗体偶联)新药,RC98是一种新型PD-L1单克隆抗体,基于临床前研究数据,RC98相比其他PD-L1抗体具有相当或潜在更好的靶点亲和力及抗肿瘤效果。此前,维迪西妥单抗联合RC98 治疗HER2表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)适应症已获批临床。
- AZD8205
阿斯利康AZD8205拟用于治疗晚期或转移性实体恶性肿瘤。这是继翰森制药HS-20089后,国内第2家获批临床的B7-H4抗体偶联药物(ADC)。公开资料显示,AZD8205由新型拓扑异构酶1抑制剂(TOP1i)—linker—靶向B7-H4的抗体构成,其作用机制是将TOP1i弹头递送至B7-H4阳性细胞中,导致DNA损伤和细胞死亡。目前,阿斯利康在ADC产品高达12款,涉及靶点包括HER2、TROP2、CD25、PCMA等。
- KL340399注射液
6月15日国家药品监督管理局审评中心(CDE)官网公示:四川科伦KL340399注射液获批临床,批准开展瘤内注射治疗晚期实体瘤的临床试验。公开资料显示,KL340399注射液是具有全新结构、体内外药效活性显著、结构稳定且可兼顾瘤内给药及系统给药的新一代STING激动剂。STING是一种跨膜蛋白,是固有免疫信号通路中重要的接头蛋白,具有识别病毒和细菌感染以及启动机体固有防御和免疫反应的作用。激活STING通路可诱导I型干扰素和其他促炎因子的表达和分泌,激活固有免疫应答,促进抗肿瘤免疫响应,达到治疗肿瘤的目的。此前KL340399注射液已获批静脉输注给药治疗晚期实体瘤适应症,并已开展临床研究。截至目前,全球范围内暂无同靶点药物获批上市,临床研发进展最快的是默克的MK-1454,处于临床Ⅱ期。默沙东的注射用Zilovertamab vedotin获批临床,是一款靶向ROR1的抗体偶联药物(ADC),曾获美国FDA授予孤儿药资格和快速通道资格。默沙东于2020年11月以27.5亿美元收购了VelosBio公司,从而获得这款产品。
- ELPIS 人脐带间充质干细胞注射液
6月16日国家药品监督管理局审评中心(CDE)官网公示:华夏源生物自主研发的Ⅰ类生物制品ELPIS人脐带间充质干细胞注射液获得临床试验批准,用于重度狼疮性肾炎。这是华夏源继2021年ELPIS干细胞新药首款适应症中重度斑块型银屑病获批临床后开拓的新适应症。公开资料显示,华夏源ELPIS人脐带间充质干细胞注射液是国内首个受理的用于狼疮性肾炎治疗的干细胞新药。ELPIS注射液基于间充质干细胞免疫原性低,可抑制树突细胞、诱导Treg细胞的增殖,减少刺激B细胞活化,从而抑制异常的免疫应答。
- C-CAR039注射液
6月17日国家药品监督管理局审评中心(CDE)官网公示:赛比曼生物抗CD19/CD20嵌合抗原受体自体T细胞注射液C-CAR039获批临床,用于治疗复发或难治性B细胞非霍奇金淋巴瘤(r/r B-cell NHL)。公开资料显示,C-CAR039是一款新型第二代4-1BB双靶点CAR-T细胞治疗产品,具有经优化的双特异性抗原结合结构域,可同时作用于CD19和CD20双靶点,能够有效清除CD19/CD20单阳性或双阳性肿瘤细胞。C-CAR0398此前针对滤泡性淋巴瘤(一种惰性非霍奇金淋巴瘤)适应症已经获得美国FDA授予的孤儿药资格。
本周无新药获批上市。
获批临床创新药/改良型新药信息速览(不含补充申请)
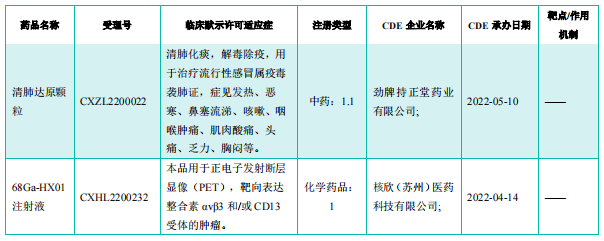
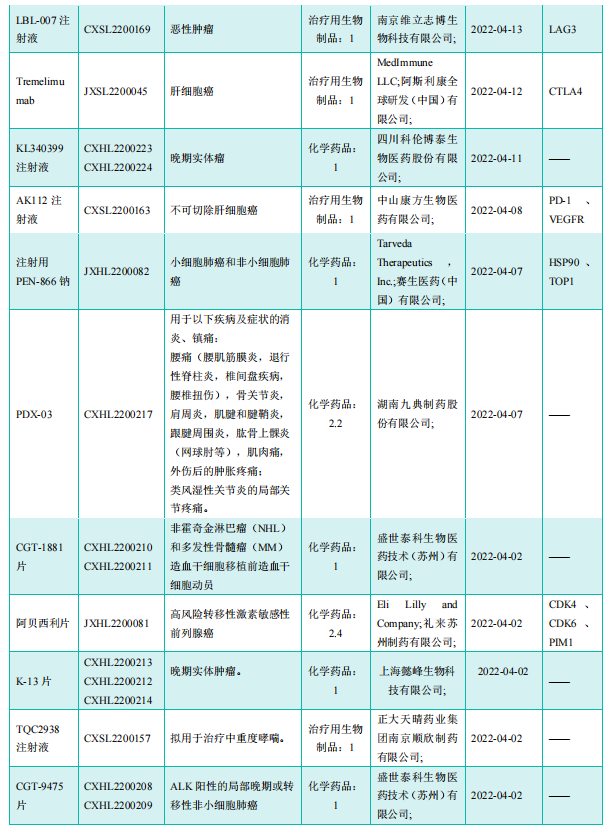

截图来源:《药融云医药行业观察周报》
备注:更多信息如获批临床/获批上市品种全球上市及研发进展详情及相关靶点全局分析等,可通过药融云投融资数据库和(或)联系药融云客服获取并下载 EXCEL 表格。
二、仿制药/生物类似物注册申报分析
根据药融云数据统计,2022.06.13-2022.06.19共有86项仿制药注册申请获CDE承办,其中新注册分类上市申请受理号52项(包括化药3类,4类,5.2类),一致性评价申请受理号34项;共2个品种通过一致性评价仿制药(按受理号计2项),本周无视同通过一致性评价品种动态。本周无生物类似物注册申报动态。
- 本周通过/视同通过一致性评价全局分析
通过一致性评价:本周仅通过琥珀酸亚铁片和乳酸环丙沙星氯化钠注射液两个品种,分别属于血液和造血系统用药和系统用抗感染药;过评企业仅湖南九典制药和四川科伦药业2家企业。
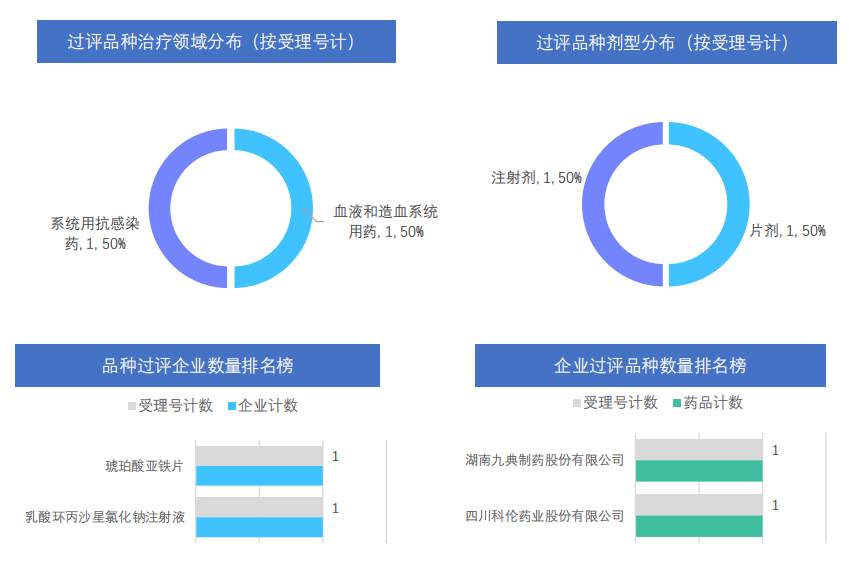
截图来源:《药融云医药行业观察周报》
视同通过一致性评价:本周无视同通过一致性评价品种。
- 本周首次过评/视同过评及过评/视同过评达3家品种盘点
- (1)本周首次过评/视同过评品种
本周无首次(视同)过评品种。
- (2)本周过评/视同过评达3家企业品种
随着本周科伦药业过评,乳酸环丙沙星氯化钠注射液这一品种的过评企业已满3家。
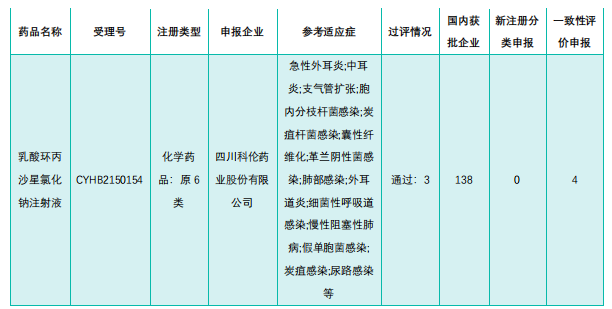
截图来源:《药融云医药行业观察周报》
备注:本章节以药融云数据库最近一周更新数据为参考依据,可通过药融云一致性评价数据库或联系药融云客服获取并下载本周过评/视同过评品种清单。
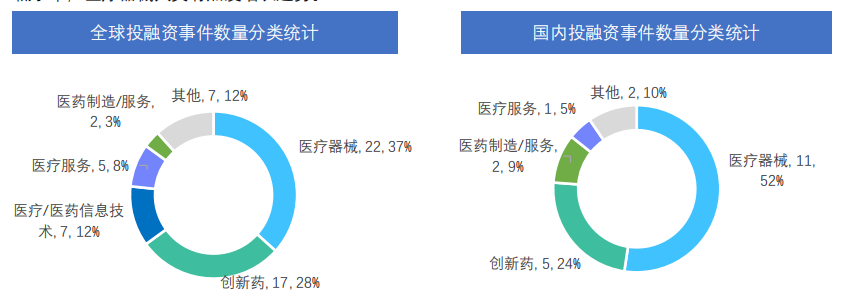
三、全球医药大健康行业投融资事件盘点
据药融云数据统计,2022年6月13号-6月19日间,全球医药大健康行业共发生投融资事件60起,较上周数量减少了4起,其中创新药类融资共17起,医疗器械投资热度也较高,本周占比为 37%,为22起。国内医药大健康行业共发生投融资事件21起,较上周数量减少了1起,其中创新药类为5起,医疗器械、医药制造/服务、医疗服务融资事件发生数量分别为11起、2起、1起。
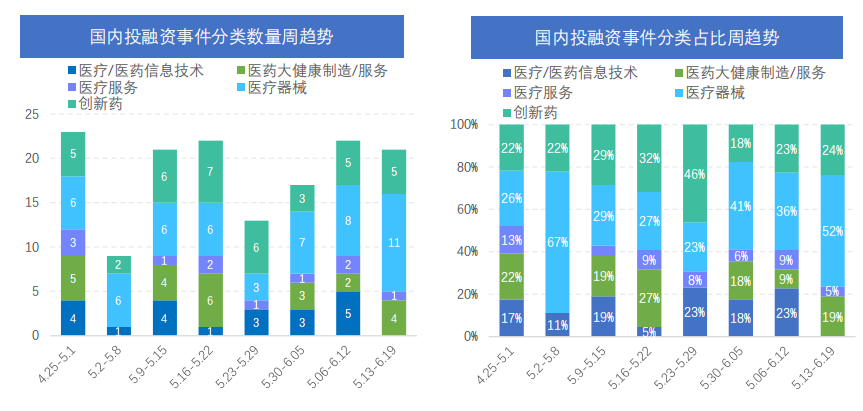
本周国内创新药大类中,肿瘤依然是资本聚焦的疾病领域,中枢神经系统领域也受到关注;从细分赛道来看,基因治疗、细胞治疗、AI驱动创新药研发为本周创新药投融资关键词。从融资金额来看,本周创新药大类中,仅有默达生物一家企业融资金额在1亿元人民币以上。从近期各大类投融资数量变化趋势来看,创新药投融资事件数量仍保持在较低水平,医疗器械大类有热度增长趋势。
截图来源:《药融云医药行业观察周报》
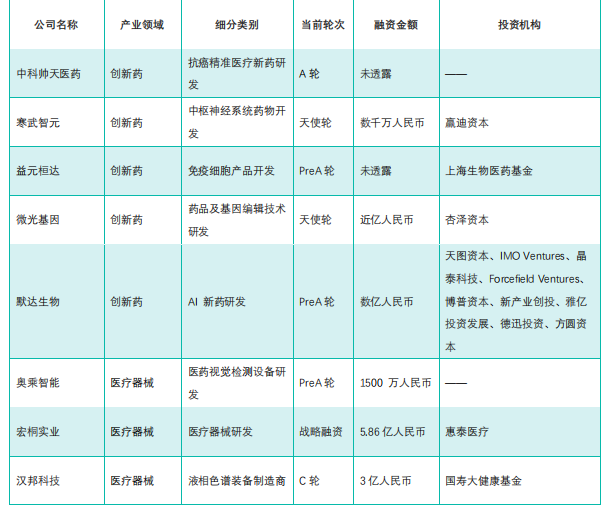
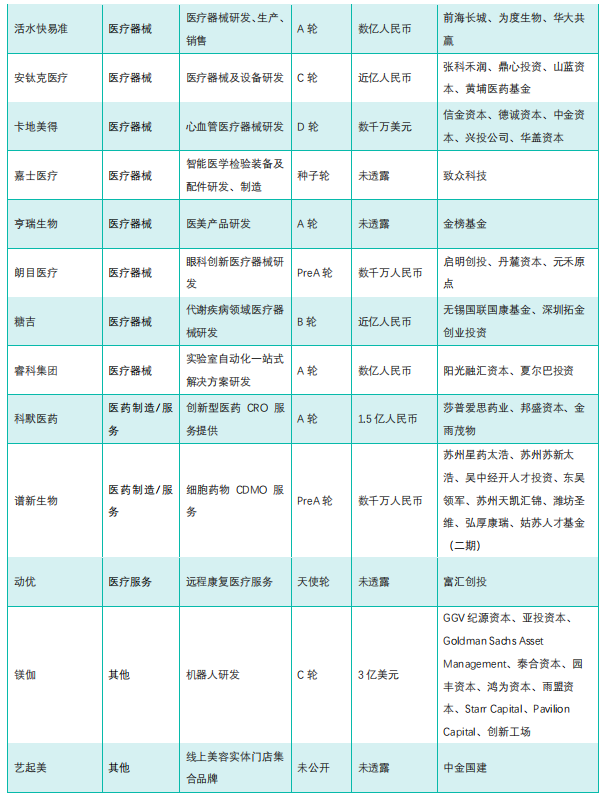
国内医药大健康行业投融资速览
截图来源:《药融云医药行业观察周报》
备注:更多信息如公司简介、历史融资信息、所在地区、最新融资时间等,可通过药融云投融资数据库和(或)联系药融云客服获取并下载 EXCEL 表格。
- 大额创新药投融资事件详细说明
近日,中国首家基于免疫代谢靶点的小分子创新药研发公司深圳默达生物科技有限公司(META Pharmaceuticals Inc)宣布连续完成共计上亿元的种子轮和Pre-A轮融资,领投方包括Forcefield Ventures、晶泰科技、IMO Ventures、天图资本,另有方圆资本、德迅投资、雅亿资本、新产业创投和博普资本等跟投。此次融资将用于加速默达生物在研的三个小分子靶向创新药向临床试验推进,并进一步拓展其AI代谢酶靶点发现平台的开发,在更多不同适应症上完成预测和验证。
深圳默达生物科技有限公司基本信息及投融资情况
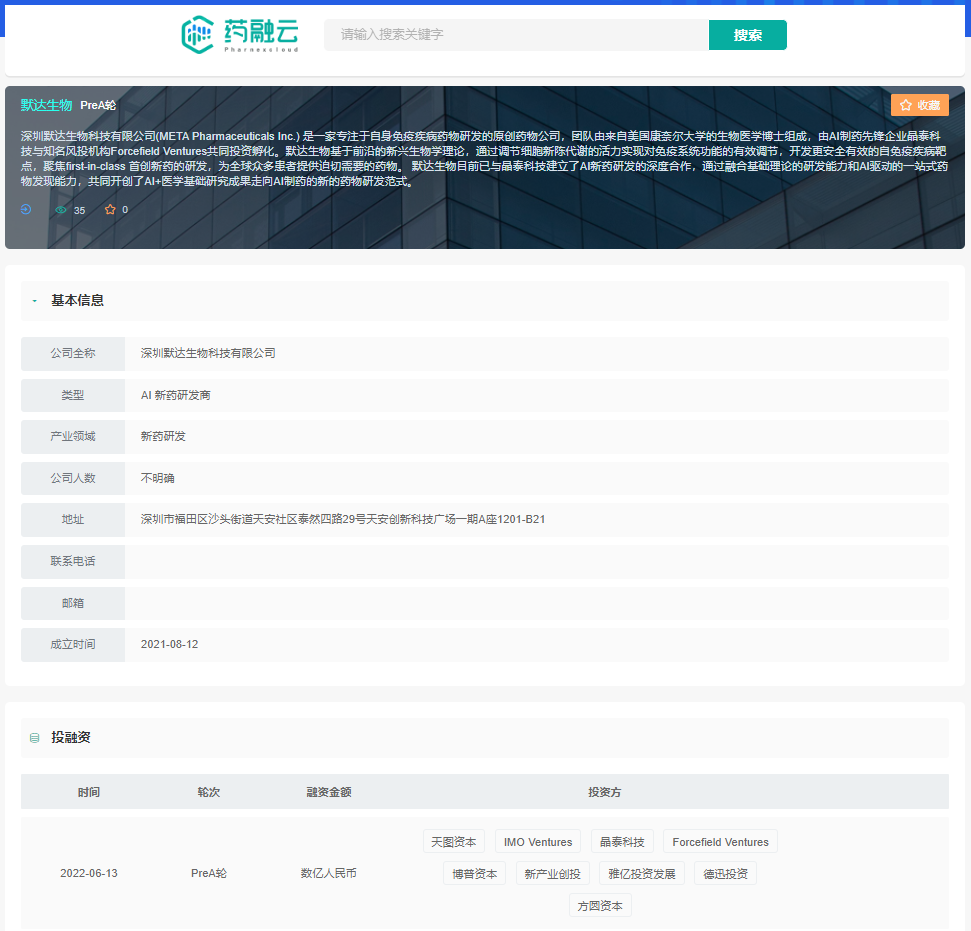
截图来源:药融云投融资数据库
四、全球创新药研发进展
- 信达生物PCSK9抑制剂托莱西单抗在华申报上市
13日,信达生物PCSK9抗体托莱西单抗注射液的上市申请获得NMPA受理,为首个申报上市的国产PCSK9抗体。公开资料显示,托莱西单抗(tafolecimab,IBI-306)是信达生物开发的一种靶向PCSK9的单克隆抗体,拟开发用于治疗非家族性高胆固醇血症(non-FH)及杂合子家族性高胆固醇血症(HeFH)等适应症,此前已在3期临床研究中达到主要研究终点。
- 阿斯利康/默沙东MEK抑制剂在中国申报上市
13日,CDE官网最新公示,阿斯利康递交了5.1类新药selumetinib胶囊的上市申请并获得受理,同时它已经被正式纳入优先审评,拟用于3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的1型神经纤维瘤病(NF1)儿科患者的治疗。
- 美国FDA宣布批准口服JAK抑制剂巴瑞替尼上市用于治疗斑秃患者
14日,美国 FDA 宣布,批准礼来和Incyte公司联合开发的口服JAK抑制剂巴瑞替尼上市,用于治疗严重斑秃成人患者。这是FDA批准用于治疗斑秃的首款系统性疗法。
- FDA 批准Alnylam 公司RNAi疗法Amvuttra上市
13日,Alnylam宣布,FDA批准该公司RNAi疗法Amvuttra(vutrisiran)上市,用于治疗成人遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性多发性神经病变。这是FDA批准的首款只需每3个月皮下注射一次,就能够逆转神经病变损伤的RNAi疗法。
- 恒瑞医药 SHR4640 片获得药物临床试验批准通知书
15日,恒瑞医药发布公告称,公司收到国家药监局核准签发关于SHR4640片的《药物临床试验批准通知书》,将于近期开展临床试验。SHR4640片为恒瑞医药自主创新的1类抗痛风药物,其阳性对照药为阿斯利康旗下子公司Ardea Biosciences Inc开发的Lesinurad。
......
药物的研发是一个极其复杂、费时费力的事情,实时掌握每周医药行业内发生的大小事,对药物的研发有很大的帮助。全面了解市场研发动态,随时跟进药企产品研发进展,及时发现医药行业新契机,研发人员也能站在时讯的至高点,随机应变,及时调整研发策略与方向,知己知彼、少走弯路、统筹全局、运筹帷幄。
药融云咨询团队联合药学数据分析团队每周将会准时推出药融云《医药行业观察周报》,内含一周内医药行业核心数据回顾、行业政策要闻、全球创新药研发进展、本周全球积极/失败临床结果、全球医药企业 BD 交易/战略合作事件盘点、国内上市企业动态、国内医药企业国际化动态等动态。

以上为2022.06.13-2022.06.19期间医药行业发生事件的部分内容,想要获取完整报告,关注“药融云”公众号(gh_d20f87bd52d9),回复关键词“报告”即可领取。
药融云2022.06.13-2022.06.19医药行业观察周报目录



<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论