
药用包装材料和容器由于直接接触药品且贮存药品时间较长,对保证药品质量和保障人体用药安全具有重要作用。其中,药用玻璃主要用于注射剂等产品的包装,其化学稳定性会直接影响药品质量。作为注射剂不可分割的一部分,玻璃中的某些成分被所接触的药品析出,或者玻璃中元素离子发生迁移等,都可能造成注射剂药效衰减,甚至出现药品不治病。药用玻璃的选择除了影响国产注射剂的药效外,还影响着国内各大药企的生产成本和仿制药一致性评价的结果等。因此,近年来,药企对仿制药注射剂“包材选择的合理性”的研究也愈加重视。
那么,用于注射剂的包装容器应如何选择?目前国内的审评尺度如何?国内外相关法规对包材的要求以及如何证明包材选择的合理性?本文就这些问题展开讨论,借此抛砖引玉,以期探索出符合现行技术及法规要求的研究策略。
1、药用玻璃的分类
注射剂直接接触药品的包材通常有塑料(聚乙烯、聚丙烯、环状聚烯烃等)、弹性体(橡胶类、热塑性弹性体等)和药用玻璃等。根据2020年版《中国药典》四部“9622药用玻璃材料和容器指导原则”,药用玻璃可以从成型方法、化学成分和性能、耐水性等进行分类。
药用玻璃根据成型方法,可分为:人工吹制玻璃、模制玻璃和管制玻璃。人工吹制玻璃是一项古老的工艺,现在使用较少,主要用来制造艺术品。目前,医药玻璃瓶主要是模制瓶和管制瓶。模制瓶的瓶壁较厚,适合来制作输液瓶、口服液瓶等较大的瓶子。而管制瓶相对更薄,厚度均匀,容量小,较为美观,主要用于小容量注射剂等。
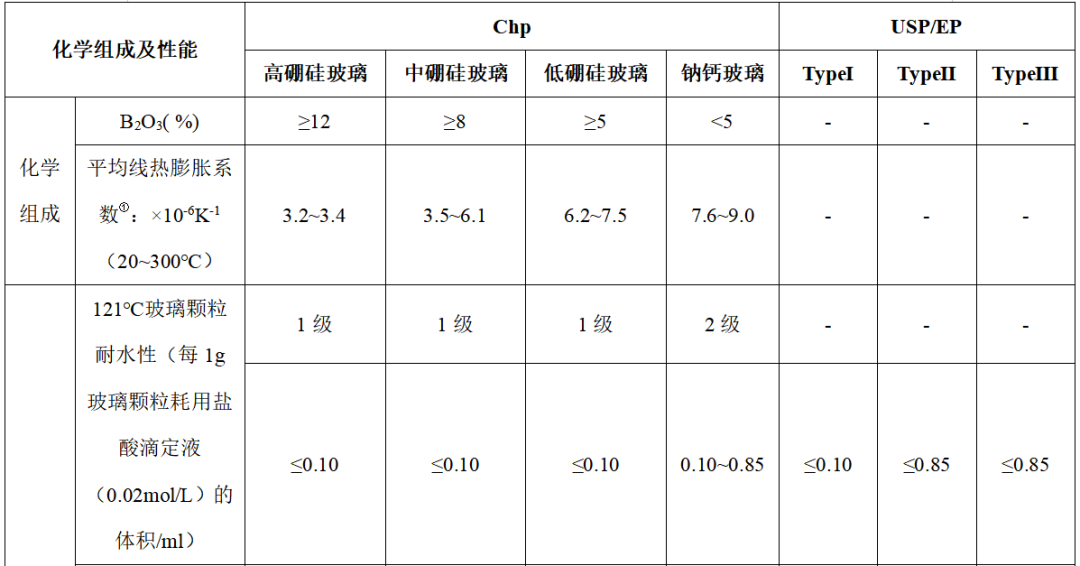
药用玻璃根据线热膨胀系数和三氧化二硼含量的不同,结合玻璃性能要求分为高硼硅玻璃、中硼硅玻璃、低硼硅玻璃和钠钙玻璃四类。药用玻璃化学成分以 SiO2为主成分,添加一定比例的 B2O3和少量碱金属氧化物、碱土金属氧化物和三氧化二铝等。
药用玻璃按颗粒耐水性的不同分为Ⅰ类玻璃、Ⅱ类玻璃和Ⅲ类玻璃。Ⅰ类玻璃即为硼硅类玻璃,具有高的耐水性;Ⅱ类玻璃是Ⅲ类玻璃制成容器的内表面经过中性化处理后,可达到高的内表面耐水性的玻璃;Ⅲ类玻璃即为钠钙类玻璃,具有中等耐水性。
除中国药典外,美国药典和欧洲药典也收载了药用玻璃的分类及性能要求(见表1)。从不同类型的玻璃瓶的耐水性标准可判断,TypeⅠ相当于硼硅玻璃;TypeⅢ相当于钠钙玻璃。
表 1 玻璃材料种类及其成分和性能要求
2、常见的发补意见
目前,受国内药用玻璃瓶的生产技术和成本因素的制约,大多数注射剂生产企业使用了钠钙玻璃、低硼硅玻璃等材质的包装,然而这些包材在许多国家都是不允许用于注射剂等高风险制剂的。自2019年10月15日,国家药品监督管理局发布化学注射剂仿制药一致性评价征求意见稿以来,在注射剂一致性评价审评过程中,几乎所有的审评意见都提到建议更换中硼硅玻璃管制注射剂瓶进行包材相容性研究。常见的审评意见有:
项目A:请将本品包材更换为中硼硅玻璃注射剂瓶,以保证药品上市后质量持续稳定,请按照相关技术要求进行包材相容性研究,提供详细研究资料。
项目B:本品采用低硼硅玻璃管制注射剂瓶包装,目前通过一致性评价的同品种均采用中硼硅玻璃管制注射剂包装。为保障药品上市后质量持续稳定,建议将本品包装更换为中硼硅玻璃管制注射剂瓶,并按照相关技术要求进行包材相容性研究,提供相关研究资料。
由此可见,虽然目前暂无明确的法规要求,但采用中硼硅玻璃瓶作为注射剂的包装容器已然成为趋势。
3、为什么要采用中硼硅玻璃瓶
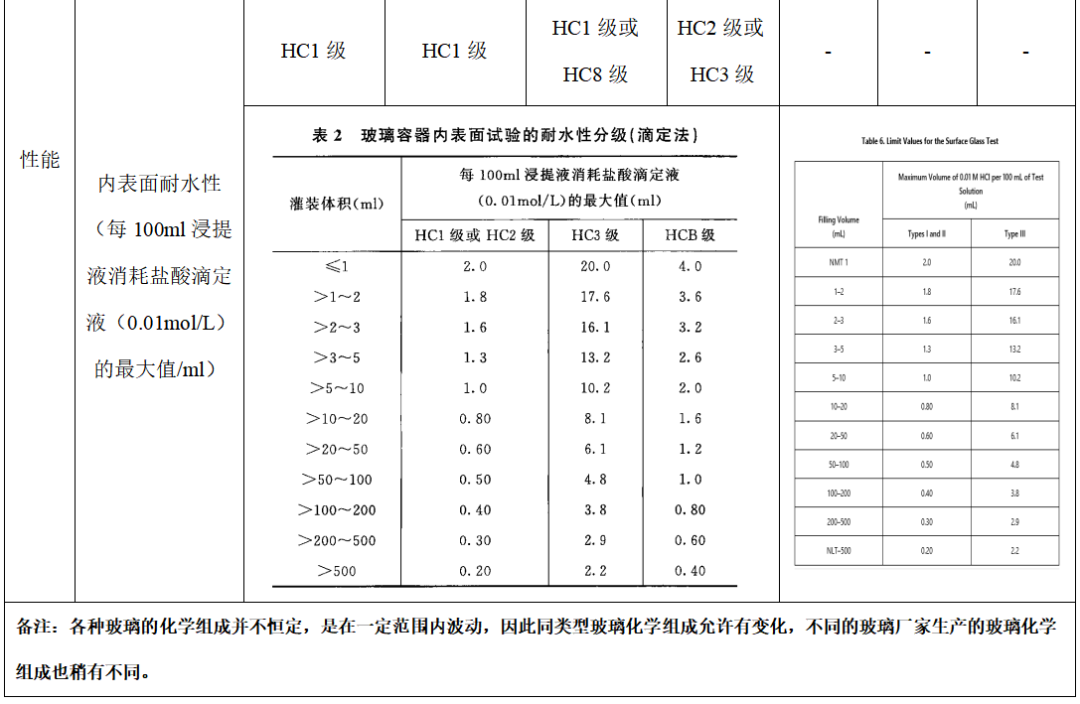
在药用玻璃领域,有一个非常重要的参数,叫做耐水性。指的是在特定条件下单位质量玻璃析出碱的量,用消耗的0.02mol/L的HCl的体积量来表示。玻璃表面析出碱的量越少,耐水性等级越高,对水性药品影响就越小。也就是说材料性质越稳定,玻璃耐水性越好,和瓶内药品发生化学反应的可能性就越低,保存的药品也就越安全可靠。
中性硼硅玻璃与其他药用玻璃瓶相比,在确保药品质量方面具有不可比拟的优越性:一是膨胀系数小,耐极冷极热性强:二是加工过程中不易炸裂,机械强度高,抗冲击性强;三是化学稳定性好,耐酸耐碱耐水级别高,能保证药品有效期,减少和避免白点、脱片及可见异物的发生。
4、药包材相关法规要求
4.1 我国药包材监督管理的发展史
自20世纪80年代起,我国药包材行业进入了快速发展的新阶段,各类现代化药包材开始出现,与此同时,市场对药包材的重视度日益增强,国家的监管力度逐渐增强,监管制度也日渐完善。为方便全面了解我国药包材监管制度的发展史,现将近40年来国内药包材监管相关的法规梳理如下:

4.2 注射剂一致性评价“包材选择”的法规要求
2017 年12 月,国家药监局发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,明确提及了“不建议使用低硼硅玻璃和钠钙玻璃”。虽然没有进行硬性规定,但政策的导向性已经十分明确。
2020年5月,国家药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》,其中描述变为“注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致”。
4.3 国内药包材的执行标准
自20世纪90年代末起,为统一药包材的产品技术标准、提高药包材质量,国家开始制定了多项国家标准和行业标准。国家食品药品监督管理局自2002年以来分期分批组织制定并发布了113项药品包装容器(材料)标准(包括2004年计划发布标准),其中药用玻璃包装容器(材料)标准43项。
2015年8月11日,国家食品药品监督管理总局发布YBB 00032005—2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器国家标准(2015年第164号),对现行的139项药包材标准进行了修订完善,对部分标准进行了合并和提高,最终形成130项药包材国家标准,自2015年12月1日起实施。
5、如何证明包材选择的合理性
早期的药学研究中,大多数药企采用稳定性试验数据支持包材选择的合理性,然而这种方法存在明显的缺陷。2020年版《中国药典》四部中提到,“药包材与药品的相容性研究是选择药包材的基础,药物制剂在选择药包材时必须进行药包材与药品的相容性研究”。
包材相容性研究主要包括三个方面,一是器具、包装系统对药品的影响(包括浸出物、迁移物、吸附活性成分和/或功能性辅料等),二是药品对器具、包装系统的影响(包括器具的变形或变性、包装系统的保护性和密封完整性被破坏等),三是包装制剂后药物的质量变化(即药物稳定性)。
包材相容性的研究可参考2020年版《中国药典》四部、《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则》、《化学药品与弹性体密封件相容性研究技术指导原则》、《化学药品注射剂与塑料包装材料相容性研究技术指导原则》、《ICH Q3D 元素杂质指南》、美国药典<1660>、<1661>等开展相关试验。
值得注意的是,包材相容性研究并不是简单地对包装后的药品进行检测,得到的一个最终结果的事,而是基于产品的设计来考量,并且贯穿于药品研发及上市的整个生命周期。因此,包材相容性研究是包材选择的合理性及合规性确认。
参考来源:
[1] 2020年版《中国药典》四部9622/4001/4006
[2] USP General Chapters <660> Containers-Glass
[3] 国际标准ISO 12775 - 1997《正常大规模生产的玻璃按成份分类及其试验方法》
[4](国家质量监督检验检疫总局,中国国家标准化管理委员会.药用玻璃及其玻璃容器碱溶出量试验方法:GB/T 4771-2015[S]. 北京:中国标准出版社.)。
[5] 干货/最全的包材相容性的研究思路集锦
[6] 中硼硅玻璃与药用玻璃瓶生产 http://www.scicat.cn/yy/20210918/5220.html
[7] “一类中硼硅玻璃瓶”中国药玻产业的进程https://k.sina.com.cn/article_5895622040_15f680d9802001222t.html#/
<END>



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论