8月全球在研新药与靶点月报内容亮点
8月国内新药获批临床情况
· 共有143款新药获批临床
· 较上个月增加了3款,其中包括59款化药,80款生物制品,4款中药。
· 8月数量最多的新药为抗肿瘤药和免疫机能调节药物,有110个
· 消化系统与代谢药物获批数量也比较多,有20个
全球获孤儿药/突破性/快速通道资格认定品种盘点
· 8月共有46款药物获孤儿药/突破性/快速通道资格认定品种
全球在研创新药积极/失败临床结果最新动态速递
· 拜耳公布“first-in-class”疗法Kerendia 3期临床结果
· YAldeyra Therapeutics公布reproxalap3期临床数据,治疗干眼症
· Citius Pharmaceuticals公布CTCL疗法Lymphir的3期临床数据
· 安进公司公布Lumakras与Vectibix构成的组合疗法的3期临床数据
每月相关创新药最新政策速递、国内新药注册申报、全球获孤儿药/突破性/快速通道资格认定品种盘点、全球在研创新药积极/失败临床结果TOP20、全球创新药研发进展TOP20等,药融咨询团队基于真实可溯源的全球医药数据,将每月推出「全球在研新药月报」, 以期帮助业内人士通盘把握每月全球范围内的新药开发情况,全面而深入的了解全球新药开发动态。
一、8月国内新药获批临床/上市情况
根据药融云数据统计,2024年8月共有143款新药获批临床(共计224个受理号),较上个月增加了3款,其中包括59款化药,80款生物制品,4款中药。

截图来源:药融咨询月报
本月获批临床受理号数量最多的新药为抗肿瘤药和免疫机能调节药物,有110个,占比为49%,消化系统与代谢药物获批数量也比较多,有20个。获批剂型主要为片剂与注射剂,分别有78个,20个。
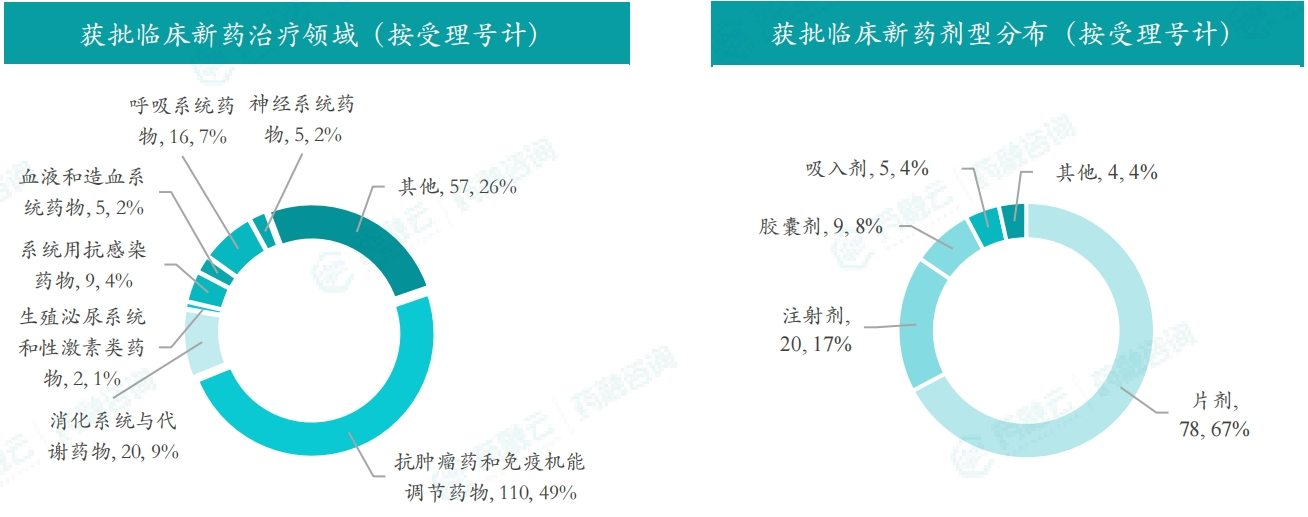
截图来源:药融咨询月报
在8月份,国内医药市场迎来了9款创新药物的获批上市,涉及信达生物;康龙化成(宁波)科技的福泽雷塞片,适应症为至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者;苏州盛迪亚生物医药的夫那奇珠单抗注射液,适合接受系统治疗或光疗的中重度斑块状银屑病的成人患者。还有更多药企均迎来新的进展。
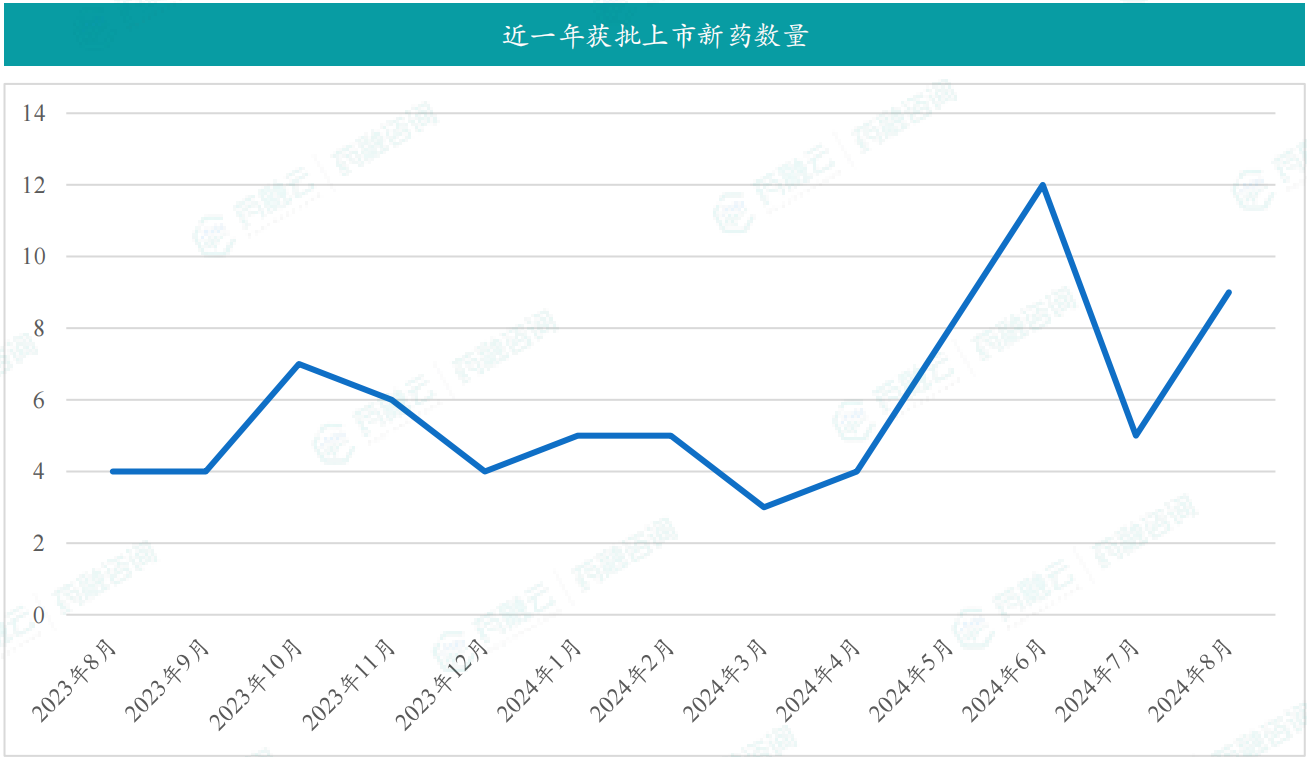
截图来源:药融咨询月报
二、全球获孤儿药/突破性/快速通道资格认定品种盘点
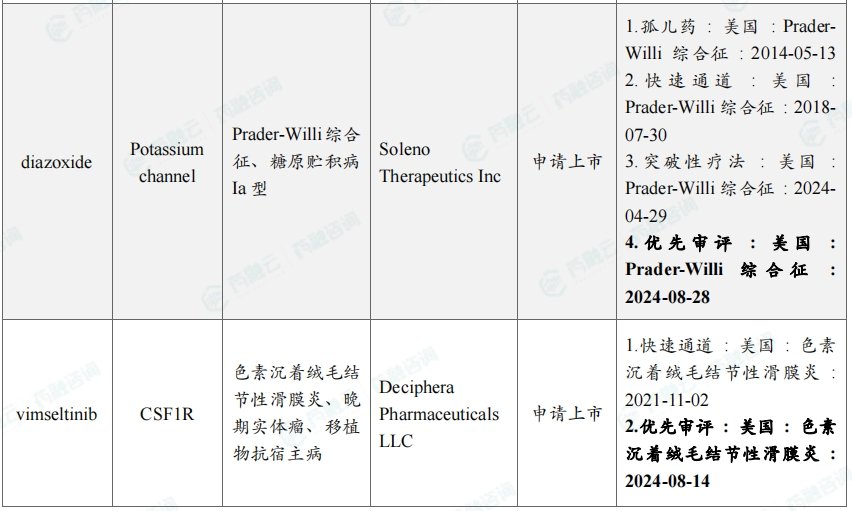
8月共有46款药物获孤儿药/突破性/快速通道资格认定。强生宣布,美国FDA批准其EGFR/MET双特异性抗体amivantamab联合第三代EGFR-TKI口服药物lazertinib用于一线治疗经美国FDA批准检测证实带有EGFR外显子19缺失或外显子21中L858R替代突变的局部晚期或转移性非小细胞肺癌(NSCLC)成年患者。
8月本月全球孤儿药/突破性/快速通道资格认定品种(部分)一览表

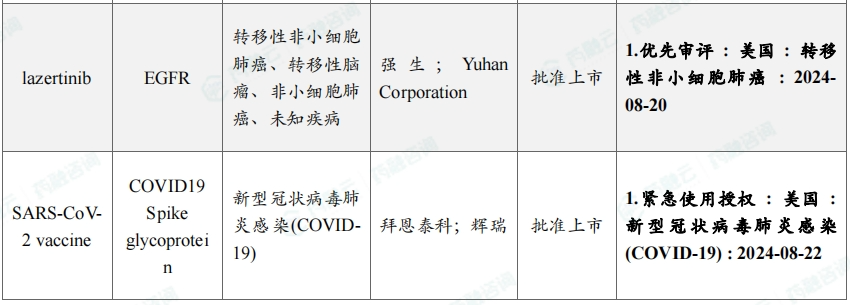
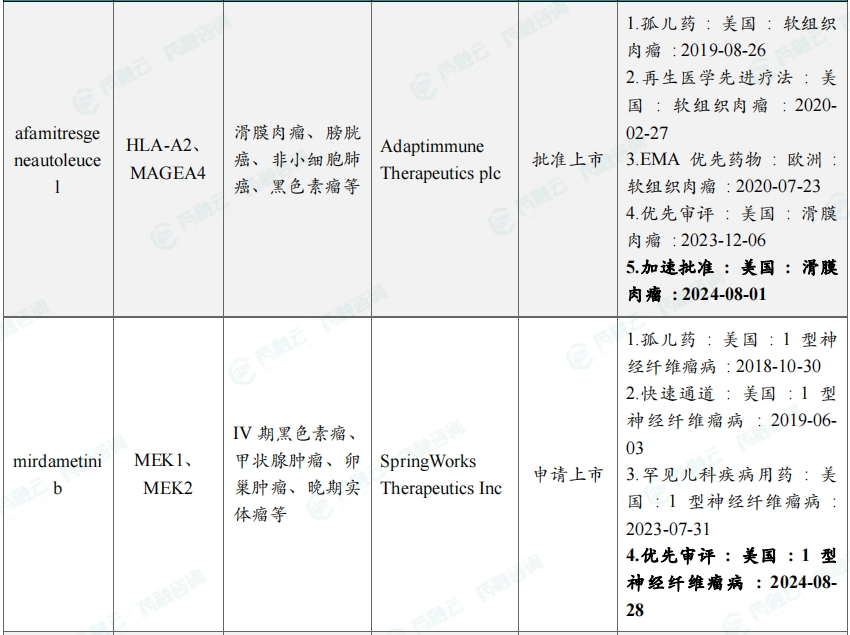
三、全球在研创新药积极/失败临床结果TOP20
在8月全球创新药研发动态中,辉瑞公司宣布了正在进行的关键性3期临床试验 MONeT 的子研究 B 的安全性和免疫原性结果,结果显示在免疫功能低下的成年患者中,接种两剂 Abrysvo 疫苗具有良好的安全性和免疫原性。
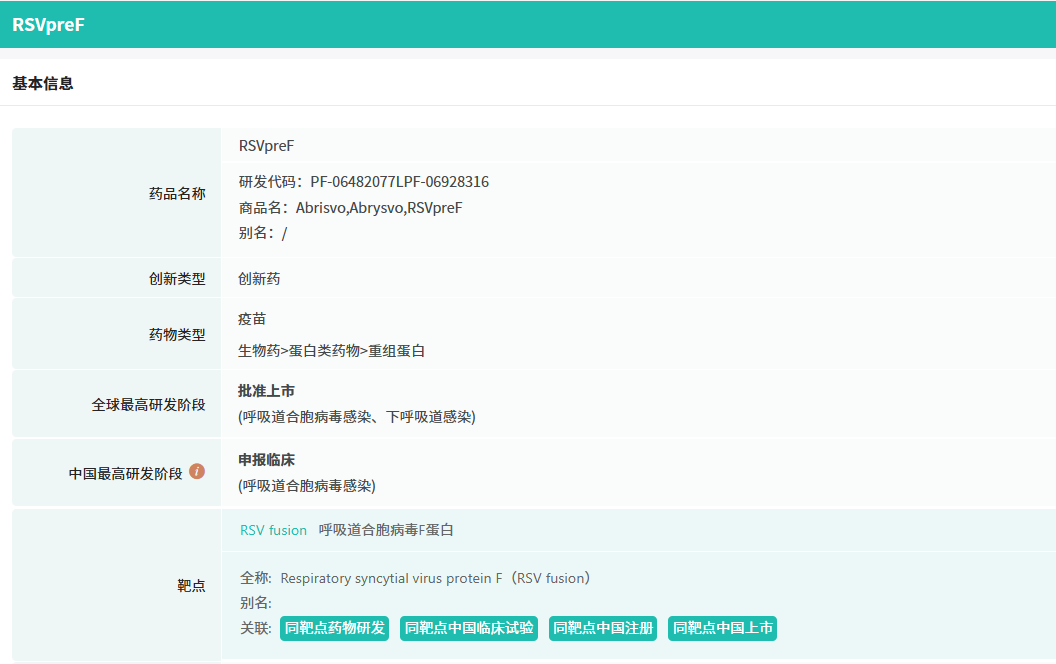
截图来源:药融云全球药物研发数据库
此外,拜耳公司宣布其“first-in-class”疗法 Kerendia(finerenone)的 3期临床结果。Kerendia在治疗左心室射血分数(LVEF)≥40%的心力衰竭(HF)患者的 3 期临床试验 FINEARTS-HF 中达到主要终点,显著减少了心血管死亡和心力衰竭事件构成的复合指标。

截图来源:药融云全球药物研发数据库
8月21日,礼来公布其重磅药物tirzepatide为期三年的 SURMOUNT-1 临床 3期研究的积极顶线结果。分析显示,每周注射一次 tirzepatide可使糖尿病前期的肥胖或超重成人进展为2型糖尿病的风险显著降低 94%。此外,tirzepatide可使患者在整个治疗期间持续减重。在治疗期结束时,接受15mg 剂量治疗的成人体重平均下降 22.9%。Tirzepatide是一款葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂,可同时激活GLP-1受体和GIP受体介导的信号通路。GIP和 GLP-1是调控血糖的天然的肠促胰岛素激素。04
四、全球创新药研发进展TOP20
在8月全球创新药研发进展TOP20榜单中,亮点纷呈。首先,恒瑞医药宣布夫那奇珠单抗注射液获得临床试验默示许可,拟开发治疗适合接受系统治疗或光疗的 6 至小于 18 岁儿童和青少年中重度斑块状银屑病患者。紧接着,海思科1类新药HSK44459片获得临床试验默示许可,拟开发治疗间质性肺疾病。根据海思科此前公告介绍,这是其自主研发的一个全新的治疗间质性肺疾病的药物,为一种高选择性的环核苷酸磷酸二酯酶 4B(PDE4B)抑制剂。

截图来源:药融云全球药物研发数据库
同日,博安生物也传来佳音,博安生物宣布美国 FDA 已同意其自主研发的度拉糖肽注射液(BA5101)在美开展临床试验。BA5101 为 Trulicity 的生物类似药,拟用于 2 型糖尿病患者的血糖控制。
以上内容均来自药融咨询{2024年8月全球在研新药与靶点月报},如需查看或下载完整版报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论