1.5.1 本周全球TOP10创新药研发进展
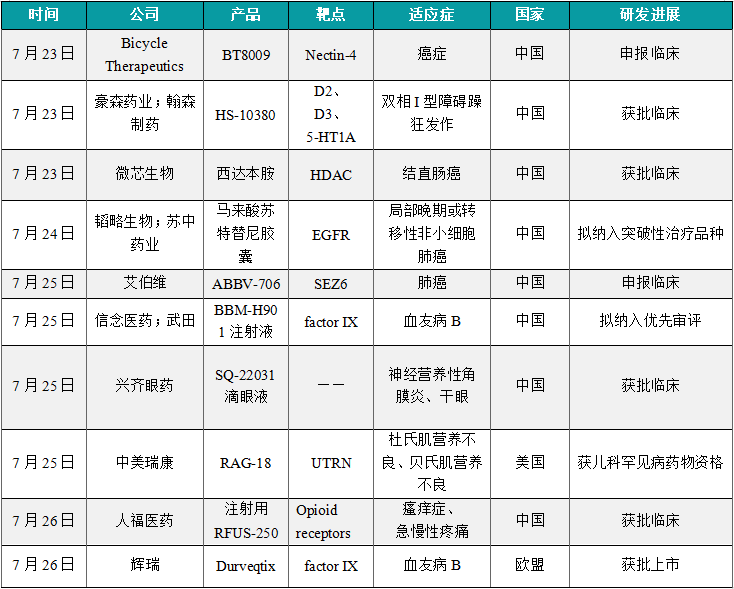
(1)Bicycle Therapeutics抗癌症药物BT8009在中国申报临床
7月23日,Bicycle Therapeutics公司的双环肽偶联毒素抗癌症药物BT8009在中国申报临床。公开资料显示,这是这款药物首次在华申报临床。BT8009是Bicycle Therapeutics公司研发的第二代双环肽偶联毒素在研疗法,靶向Nectin-4。双环肽是由9-20个氨基酸组成的多肽,能以高亲和性和选择性与靶标结合,具有高肿瘤渗透性特性并可通过健康器官快速排出。值得一提的是,该公司的双环肽技术曾获得罗氏(Roche)、拜耳(Bayer)、诺华(Novartis)等多家公司青睐,并与之达成高额合作。
(2)1类新药HS-10380获批临床,针对躁狂抑郁症
7月23日,豪森药业/翰森制药申报的1类新药HS-10380的两项临床申请获得批准,拟治疗双相I型障碍躁狂发作。双相I型障碍躁狂发作是双相障碍(也被称为躁狂抑郁症)的表现类型之一。HS-10380是翰森制药神经系统疾病领域的自主研发项目之一。公开资料显示,HS-10380是一款D2、D3受体和5-HT1A部分受体多靶点激动剂,对5-HT2A受体具显著拮抗作用,有望改善精神疾病患者的症状。临床前研究发现,HS-10380对5-HT1A和5-HT2A受体的竞争结合能力优于同类对照药物,同时具有较高的血浆暴露量,在动物模型中表现出良好药效。
(3)微芯生物西达本胺三联疗法获批临床,针对结直肠癌
7月23日,微芯生物宣布其抗肿瘤1类新药西达本胺联合信迪利单抗和贝伐珠单抗治疗结直肠癌的3临床试验申请获中国国家药品监督管理局批准。该试验为一项随机、开放性、对照、多中心临床研究,旨在评估西达本胺联合信迪利单抗和贝伐珠单抗治疗≥2线标准治疗失败的晚期微卫星稳定或错配修复完整(MSS/pMMR)型结直肠癌患者的有效性与安全性。西达本胺是一款可口服的亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂,对肿瘤抑制性免疫微环境具有重新激活作用,可单独或联合其他药物治疗恶性肿瘤等重大疾病。
(4)小分子肺癌新药马来酸苏特替尼胶囊拟纳入突破性治疗品种
7月24日,江苏苏中药业等联合申报的马来酸苏特替尼胶囊拟纳入突破性治疗品种,针对局部晚期或转移性非小细胞肺癌(仅限非耐药性罕见EGFR突变,包括L861Q、G719X和/或S768I)。公开资料显示,苏特替尼是韬略生物研发(在中国与苏中药业合作开展研发)的一款针对EGFR非经典突变的小分子抑制剂,拟主要用于治疗携带非耐药性EGFR非经典突变(L861Q、G719X、S768I)或其他非耐药性EGFR非经典突变(E709A、E709K、R776H、G724S、G779F等),或经第三代EGFR抑制剂一线治疗后产生的耐药性EGFR非经典突变的局部晚期或转移性非小细胞肺癌。本次苏特替尼拟纳入突破性治疗品种,意味着这款EGFR抑制剂新药再次迎来新的进展。
(3)艾伯维新药ABBV-706在华申报临床,针对肺癌等
7月25日,艾伯维申报的ABBV-706注射用冻干粉临床试验申请获得受理。公开资料显示,ABBV-706是一种靶向SEZ6的抗体偶联药物(ADC),有效载荷为TOP1i,目前正在国际范围内处于1期临床研究阶段。此次是这款SEZ6靶向ADC在研产品首次在中国申报临床。SEZ6(癫痫相关同源物6,seizure-related homolog 6)是一种细胞表面蛋白,通常在神经内分泌肿瘤中高度特异性表达,包括小细胞肺癌和某些神经元组织,但在大多数正常组织中表达最低。ABBV-706使用了艾伯维专有的新型拓扑异构酶1抑制剂(Top1i)有效载荷。Top1i是一种抗癌剂,通过阻断DNA复制诱导细胞死亡。根据艾伯维官网管线资料,ABBV-706正在针对非小细胞肺癌开展1期临床研究,未来该产品还有望用于治疗小细胞肺癌、中枢神经系统肿瘤和神经内分泌癌。
(4)基因治疗药物BBM-H901注射液拟纳入优先审评,治疗血友病B
7月25日,信念医药和武田(Takeda)的基因治疗药物BBM-H901注射液新药上市申请拟纳入优先审评,用于治疗血友病B成年患者。BBM-H901注射液是信念医药研发和生产的重组腺相关病毒(AAV)基因治疗药物。该产品以静脉给药的方式将人凝血因子Ⅸ(FIX)基因导入血友病B患者体内持续表达,提高并长期维持患者的凝血因子水平,用于预防血友病B成年患者出血。2022年,BBM-H901注射液被NMPA纳入突破性治疗品种。血友病B(也称B型血友病)是血友病的第二大常见形式。血友病是一种罕见疾病,通常是先天遗传性,会因缺乏足够的凝血蛋白(凝血因子)而导致血液无法正常凝结。在中国,血友病B患者群体仍然存在未被满足的医疗需求。期待这款药物能够早日为血友病B患者带来新的治疗选择。
(5)兴齐眼药1类创新药SQ-22031滴眼液获批临床,针对干眼等
7月25日,兴齐眼药公司申报的1类新药SQ-22031滴眼液获得多项临床试验默示许可,拟用于治疗神经营养性角膜炎、干眼。干眼是一项常见的种慢性渐进性疾病,由于眼睛前侧表面不够湿润及缺乏润滑,造成眼睛干涩、发炎、疼痛、不适、刺激以及生活品质的下降,严重情况下,甚至会造成永久性的视力损伤。由于患者群体较大,干眼患者的治疗仍存在未满足需求。神经营养性角膜炎(NK)是一种因角膜神经功能受损而导致的罕见病,已经在中国被纳入《第二批罕见病目录》。本次兴齐眼药SQ-22031滴眼液获批临床,意味着其即将针对这两类疾病开展临床研究。据悉,兴齐眼药已经完成SQ-22031滴眼液药学及非临床药理毒理学等多方面的研究,研究结果表明该产品具有良好的安全性及临床开发价值。
(6)中美瑞康的RAG-18获得美国FDA的儿科罕见病药物资格
7月25日,中美瑞康(Ractigen Therapeutics)宣布其自主研发的小激活RNA (saRNA)药物RAG-18获得美国FDA的儿科罕见病药物资格(RPDD),拟用于治疗由任何DMD基因突变引起的杜氏肌营养不良(DMD)和贝氏肌营养不良(BMD)。RAG-18是中美瑞康开发的一款创新作用机制的双链saRNA药物,通过RNA激活(RNAa)机制特异性靶向激活肌肉细胞中UTRN基因表达。由UTRN基因编码的肌营养不良蛋白(utrophin)在结构和功能上与抗肌萎缩蛋白(dystrophin)相似,它的上调可以功能性替代 DMD 肌肉细胞中缺失的抗肌萎缩蛋白,从而治疗所有突变类型的DMD和BMD患者。
(7)人福医药的注射用RFUS-250获批临床,针对瘙痒、疼痛
7月26日,人福医药宣布其控股子公司宜昌人福药业申报的注射用RFUS-250获得两项临床试验默示许可,拟用于瘙痒症和急慢性疼痛的治疗。根据人福医药公告信息,RFUS-250是一款小分子阿片受体激动剂。根据中国《慢性瘙痒管理指南》的定义,瘙痒或痒是一种激发欲望去搔抓的感觉。通常将持续超过6周的瘙痒定义为慢性瘙痒,许多系统性疾病可发生瘙痒。中枢有很多调节瘙痒的系统,如存在于脊髓背角突触后细胞膜上的两种受体阿片μ受体和阿片κ受体,前者激活后促进瘙痒形成,而后者激活则抑制瘙痒,两者相互作用共同调节瘙痒的发生。
(8)Incyte的axatilimab注射液获批临床,治疗慢性移植物抗宿主病
7月26日,欧盟委员会(EC)宣布授予辉瑞(Pfizer)所开发的一次性基因疗法Durveqtix(fidanacogene elaparvovec)有条件上市许可,用于治疗重度和中重度血友病B成人患者。这些患者体内无凝血因子IX(FIX)抑制剂,且没有检测到针对腺相关病毒血清型Rh74变异体(AAVRh74var)的抗体。血友病B是一种危及生命的退行性疾病,患者由于基因出现突变,导致缺乏凝血因子IX。患有该疾病的患者容易发生关节、肌肉和内脏器官出血,出现疼痛、肿胀和关节损伤。目前的治疗包括终生每周或每月多次定期静脉输注凝血因子IX,一年可能需要进行超过一百次以上的治疗,以暂时替代或补充低水平的凝血因子。
1.5.2本周全球TOP10积极/失败临床结果



(1)Vertex Pharmaceuticals公布VX-880临床1/2期数据
7月23日,Ionis Pharmaceuticals宣布其在天使综合征(Angelman syndrome,AS)患者中进行的1/2a期研究HALOS已完成多次剂量递增(MAD)部分并取得积极成果。HALOS试验共纳入了51名AS患者,患者年龄在2至50岁之间,此次所公布的结果来自试验6个月时,MAD部分最后一个时间点的数据。结果显示,在所有年龄和基因型的患者中都观察到ION582治疗一致地改善患者的关键功能。在试验第4个月时,由临床医生所评估的Bayley-4认知评估分数显示,患者的沟通、认知和运动功能的改善超过了天使综合征自然史研究中的患者。而通过患者父母报告的Vineland-3评分和观察者报告的沟通能力指标中,也都观察到患者在关键功能领域的临床改善。此外,在试验第6个月时97%的受试者在天使综合征的症状-临床医生总体印象变化评分上表现出具有临床意义的整体改善。
(2)ViiV Healthcare公布双药复方抗病毒疗法Dovato 4期积极临床结果
7月24日,ViiV Healthcare宣布了PASO DOBLE临床4期试验的积极结果。分析显示,研究达到主要终点,即在试验48周期间,Dovato组患者体内病毒RNA≥50拷贝/mL的比例与活性对照药物相比达非劣效性。其中活性对照组中有1名参与者在48周内出现确认病毒学失败(即首次评估HIV-1 RNA≥50拷贝/毫升,然后接续第二次评估HIV-1 RNA≥200拷贝/毫升),而Dovato组中则没有患者出现此情形。关键次要终点分析显示,试验48周期间,转用活性对照药物患者(调整后平均体重变化1.81 kg,95% CI:1.28-2.34)的体重增加显著高于转用Dovato的患者(调整后的平均变化0.89 kg,95% CI:0.37-1.41),两组患者体重增加差异为0.92 kg(95% CI:0.17-1.66)。此外,48周时活性对照组(29.9%)中体重增加超过5%的患者比例也显著高于Dovato组(20%)。值得一提的是,Dovato组的体重变化在男性和女性之间没有差异,也与受试者之前的治疗方案无关。
(3)默沙东公布在研呼吸道合胞病毒预防性单抗MK-1654临床2b/3期数据
7月24日,默沙东(MSD)公司宣布在研呼吸道合胞病毒(RSV)预防性单抗clesrovimab(MK-1654)在2b/3期临床试验中取得积极结果。该抗体旨在保护婴儿免受RSV疾病的侵袭。在试验中,clesrovimab达到了试验的主要安全性和有效性终点,包括在第150天前减少由RSV引起的需要医疗干预的下呼吸道感染(MALRI)。MK-1654-004是一项2b/3期随机双盲、安慰剂对照研究,旨在评估clesrovimab在健康早产儿和足月婴儿中的安全性和有效性。参与者被随机分配接受单次剂量的clesrovimab或安慰剂。主要终点包括从第1天(给药后)到第150天与安慰剂相比,RSV相关的MALRI发生率和安全性。
(4)Arcutis Biotherapeutics的Zoryve 3期研究结果公开,治疗银屑病效果积极
7月24日,Arcutis Biotherapeutics公司宣布提交了Zoryve(roflumilast)泡沫制剂的补充新药申请(sNDA),并公布了Zoryve乳膏在斑块状银屑病中的3期临床数据。该药是一种每日一次的新一代磷酸二酯酶-4(PDE4)抑制剂,用于治疗12岁以上青少年和成人的头皮和躯干银屑病。 在3期临床试验中,Zoryve达到了共同主要终点,67.3%接受Zoryve泡沫制剂治疗的患者在第8周达到了头皮研究者全球评估(S-IGA)治疗成功的标准,定义为IGA评分为“症状清除”或“几乎清除”,并与基线相比改善2分。对照组这一数值为28.1%(P<0.0001)。46.5%的Zoryve泡沫制剂组患者达到了身体研究者全球评估(B-IGA)治疗成功的标准,而对照组为20.8%(P<0.0001)。此外,新闻稿指出,Zoryve泡沫制剂在使用后24小时内就可减轻患者的头皮瘙痒,并且具有良好的安全性和耐受性。
(5)吉利德科学公布艾滋病毒(HIV)衣壳抑制剂lenacapavir的中期临床数据
7月25日,吉利德科学(Gilead Sciences)公布其关键3期PURPOSE 1试验的中期分析详细结果,该公司每半年注射一次的艾滋病毒(HIV)衣壳抑制剂lenacapavir在女性中的HIV预防用途上显示出100%的有效性,相比于每日一次口服疗法以及HIV的背景发病率皆表现出显著的优效性。结果显示,在5338名受试者中,观察到55例新发HIV感染。其中lenacapavir组(n=2134)中没有受试者感染(0/100人年;95% CI:0.00-0.19),F/TAF组(n=2136)中有39例感染(2.02/100人年;95% CI:1.44-2.76),F/TDF组(n=1068)中有16例感染(1.69/100人年;95% CI:0.96-2.74)。在筛查群体(n=8094)中的HIV背景发病率则为2.41/100人年(95% CI:1.82-3.19)。Lenacapavir组的HIV感染率显著低于背景HIV感染率(感染率比=0.00;95% CI:0.00-0.04;P<0.001),也低于F/TDF组的HIV感染率(感染率比=0.00;95% CI:0.00-0.10;P<0.001)。
(6)辉瑞公布其血友病基因疗法giroctocogene fitelparvovec的3期积极临床结果
7月25日,辉瑞(Pfizer)临床3期试验AFFINE的积极顶线结果,该研究评估其在研基因疗法giroctocogene fitelparvovec用于治疗中度至重度血友病A成人患者的疗效与安全性。分析显示,该试验达成主要终点与关键次要终点,giroctocogene fitelparvovec与替代预防疗法相比在预防患者出血上具有优效性。AFFINE研究达到主要终点,即从试验第12周到输注后至少15个月的随访期间,与FVIII替代预防疗法相比,在总年化出血率(ABR)展现优效性。患者在接受单次3e13 vg/kg剂量的giroctocogene fitelparvovec输注后,显示出与输注前相比平均总ABR显著降低(1.24 vs 4.73;单侧p值=0.0040)。此外,该试验也达到关键次要终点。84%的受试者在接受基因疗法输注后15个月维持正常FVIII活性>5%(单侧p值=0.0086),大多数受试者的FVIII活性≥15%。此外,治疗后的平均需要治疗ABR显示出统计学上显著的下降,从输注前的4.08下降至输注后的0.07,降幅达98.3%(单侧p值<0.0001)。在整个研究期间,在所有接受基因疗法的患者中,一名患者(1.3%)在输注后恢复预防治疗。
(7)Transposon Therapeutics公布TPN-101治疗肌萎缩侧索硬化的2期临床结果
7月25日,Transposon Therapeutics宣布其在研逆转录酶抑制剂TPN-101治疗肌萎缩侧索硬化(ALS)患者2期试验的最终结果,这些患者的C9orf72基因具有六核苷酸重复扩增(C9orf72相关的ALS)。分析显示,TPN-101治疗可显著降低ALS疾病进展,并减缓患者的肺活量(VC)下降情形。在试验24周,接受TPN-101治疗的ALS患者的VC下降约为对照组的一半(最小二乘[LS]平均值变化为-8.4% vs -16.5%)。当对照组患者在开放标签期转换为TPN-101治疗时,随后的24周内VC下降(-7.2%)不到他们在双盲期的一半,并且与双盲期中TPN-101组的下降率相当。在24周的双盲期内,TPN-101组和对照组之间在修订的ALS功能评分量表(ALSFRS-R)上的下降相当(LS均值为-7.2分vs -6.7分)。原本为TPN-101组的患者在整个48周内的ALSFRS-R下降约比自然史数据预期少40%。
(8)OSE Immunotherapeutics公布潜在“first-in-class”在研疗法lusvertikimab 的2期临床结果
7月25日,OSE Immunotherapeutics公司报告了潜在“first-in-class”在研疗法lusvertikimab,在治疗溃疡性结肠炎(UC)患者的概念验证2期临床试验CoTikiS中获得的首个积极结果。这是首次抗白介素-7受体(IL-7R)单抗疗法在临床试验中表现出积极疗效结果。主要分析显示,lusvertikimab的850 mg剂量组在第10周与安慰剂组相比,显著改善MMS评分。Lusvertikimab与安慰剂之间的治疗效果差异为-0.82(95% CI:-1.63,-0.01,p=0.047)。安全性方面,lusvertikimab在诱导治疗期和随后长达6个月的开放标签扩展试验期中表现出良好的安全性和耐受性,未发现安全信号,lusvertikimab组的不良事件发生率与安慰剂组相似。
(9)Galderma公布nemolizumab治疗特异性皮炎的3期临床结果
7月26日,Galderma宣布针对特应性皮炎的3期临床试验ARCADIA 1和2的完整结果已在《柳叶刀》杂志上发表,这些试验评估了nemolizumab联合外用皮质类固醇(TCS),治疗中度至重度特应性皮炎青少年和成人患者中的疗效和安全性。在ARCADIA 1和2试验中,分别有36%和38%的nemolizumab治疗患者达到皮损消失或接近消失,定义为研究者总体评估得分为0或1,而安慰剂组分别为25%和26%(p<0.001);分别有44%和42%的nemolizumab治疗患者在湿疹面积和严重度指数评分上改善至少75%,而安慰剂组分别为29%和30%(p<0.001)。Nemolizumab是一种潜在“first-in-class”单克隆抗体,用于靶向白细胞介素-31(IL-31)受体α,并抑制IL-31信号传导。在特应性皮炎中,IL-31驱动瘙痒,并参与炎症和皮肤屏障的破坏。
(10)Calliditas Therapeutics公布setanaxib治疗原发性胆汁性胆管炎的2期临床结果
近日,Calliditas Therapeutics公布其在研疗法setanaxib的2b期临床试验数据,setanaxib与安慰剂组相比,显著改善患有原发性胆汁性胆管炎(PBC)且肝硬度增加的患者的碱性磷酸酶(ALP)水平。接受setanaxib治疗的患者在主要终点ALP上显示出显著的改善,在1600 mg组中为19%,在1200 mg组中为14%,并且在24周时在FibroScan评估的肝硬度上显示出积极趋势。Setanaxib治疗总体上耐受性良好,治疗出现不良事件(TEAE)以及严重TEAE的数量在治疗组和安慰剂组之间相似。因不良事件导致研究中止的频率在接受setanaxib治疗的患者中高于安慰剂组。Setanaxib是一种NOX1/4抑制剂。NOX1和NOX4是产生活性氧(ROS)的酶,这些酶通过导致氧化应激、炎症和组织重塑,在纤维化疾病的发展中起着关键作用。
同期事件:
1. 2024年第30周07.22-07.28国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第30周07.22-07.28国内仿制药/生物类似物申报/审批数据分析
3. 2024年第30周07.22-07.28国内医药大健康行业政策法规汇总
4. 2024年第30周07.22-07.28全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.07.22-2024.07.28)},如需查看或下载报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论