分析国内新药注册申报情况,盘点全球获孤儿药/突破性/快速通道资格认定品种,了解全球在研创新药积极/失败临床结果最新动态,掌握国产创新药国际化、跨国企业创新药在华动态,盘点国内创新药投融资事件.....尽在药融云《全球在研新药与靶点月报》。
药融云5月的《全球在研新药与靶点月报》中,报道了5月备受瞩目的全球在研创新药取得的临床积极/失败结果,这些成果在治疗癌症和传染病等方面具有重大意义,预示着这些创新药有望获得更广泛的应用。
一、信达生物PD-1抑制剂3期临床数据达到预设标准
信达生物宣布,在国际权威期刊《柳叶刀·呼吸病学》(TheLancetRespiratoryMedicine)发表了3期临床ORIENT-31研究的第二次期中分析及生存分析结果。
ORIENT-31研究是一项随机、双盲、多中心3期临床研究,旨在比较信迪利单抗联合或不联合贝伐珠单抗以及化疗(培美曲塞和顺铂)用于经EGFR-TKI治疗进展的EGFR突变的局部晚期或转移性非鳞状NSCLC患者的有效性和安全性。
ORIENT-31研究临床试验结果详情查询
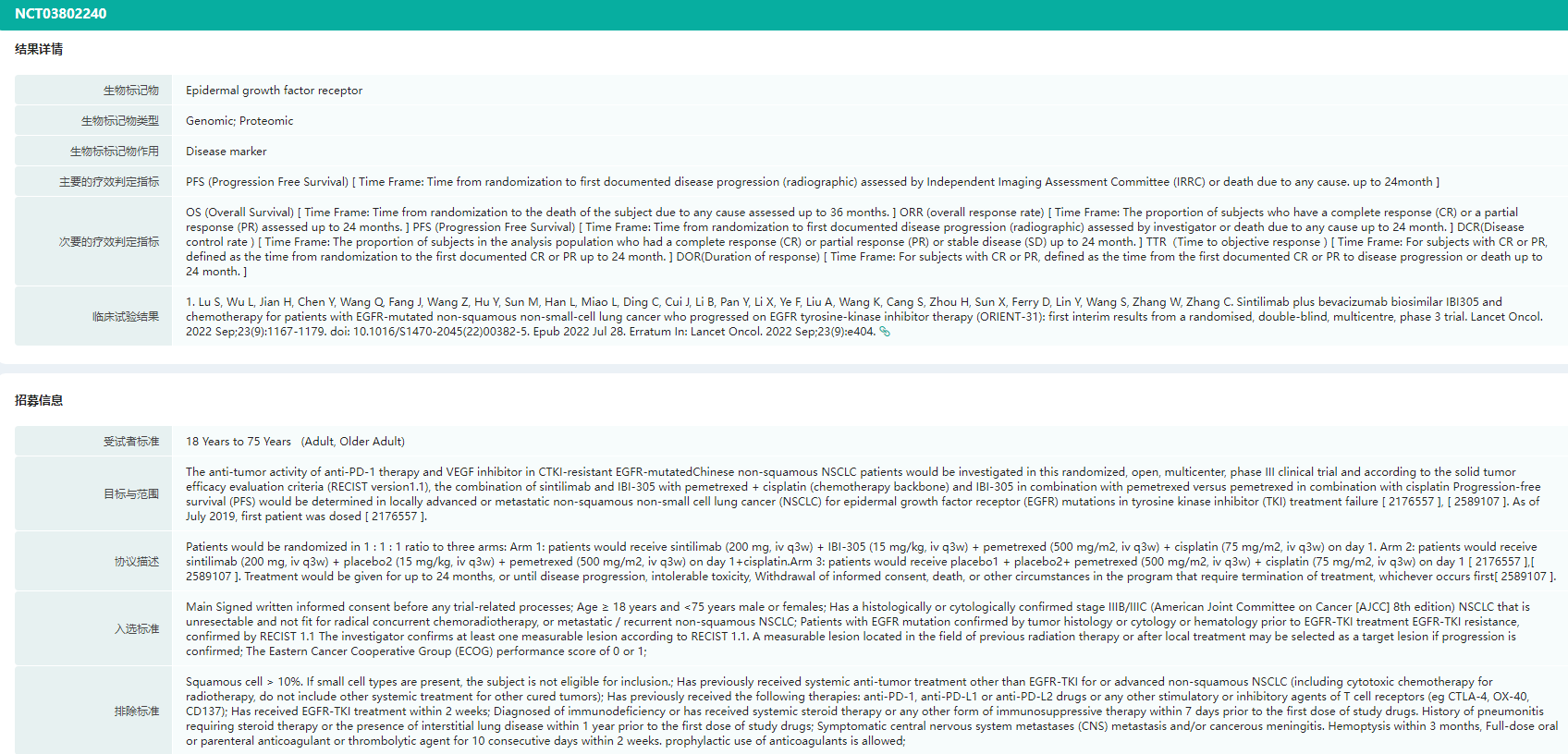
图片来源:药融云全球临床试验数据库
其临床数据显示,基于独立影像评估委员会(IRRC)评估,三组受试者中位PFS分别为7.2个月、5.5个月和4.3个月。相比对照组C,试验组A的PFS保持显著获益(HR=0.51);试验组B同样获得了显著的PFS延长,HR为0.72,达到预设的优效性标准。
ORIENT-31研究是全球首个证实免疫联合治疗为EGFR-TKI耐药的NSCLC患者带来显著生存获益的前瞻性、随机、双盲、多中心Ⅲ期临床研究。
信迪利单抗是信达生物和礼来(EliLillyandCompany)共同合作研发的一款创新PD-1抑制剂药物。药融云数据库显示,信迪利单抗于2018年12月在国内获批上市,目前该药已获批6项适应症,涵盖非小细胞肺癌、胃转移性恶性肿瘤、食管转移性恶性肿瘤、肝细胞癌、转移性非小细胞肺癌、霍奇金淋巴瘤。
信迪利单抗不同适应症研发详情查询(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
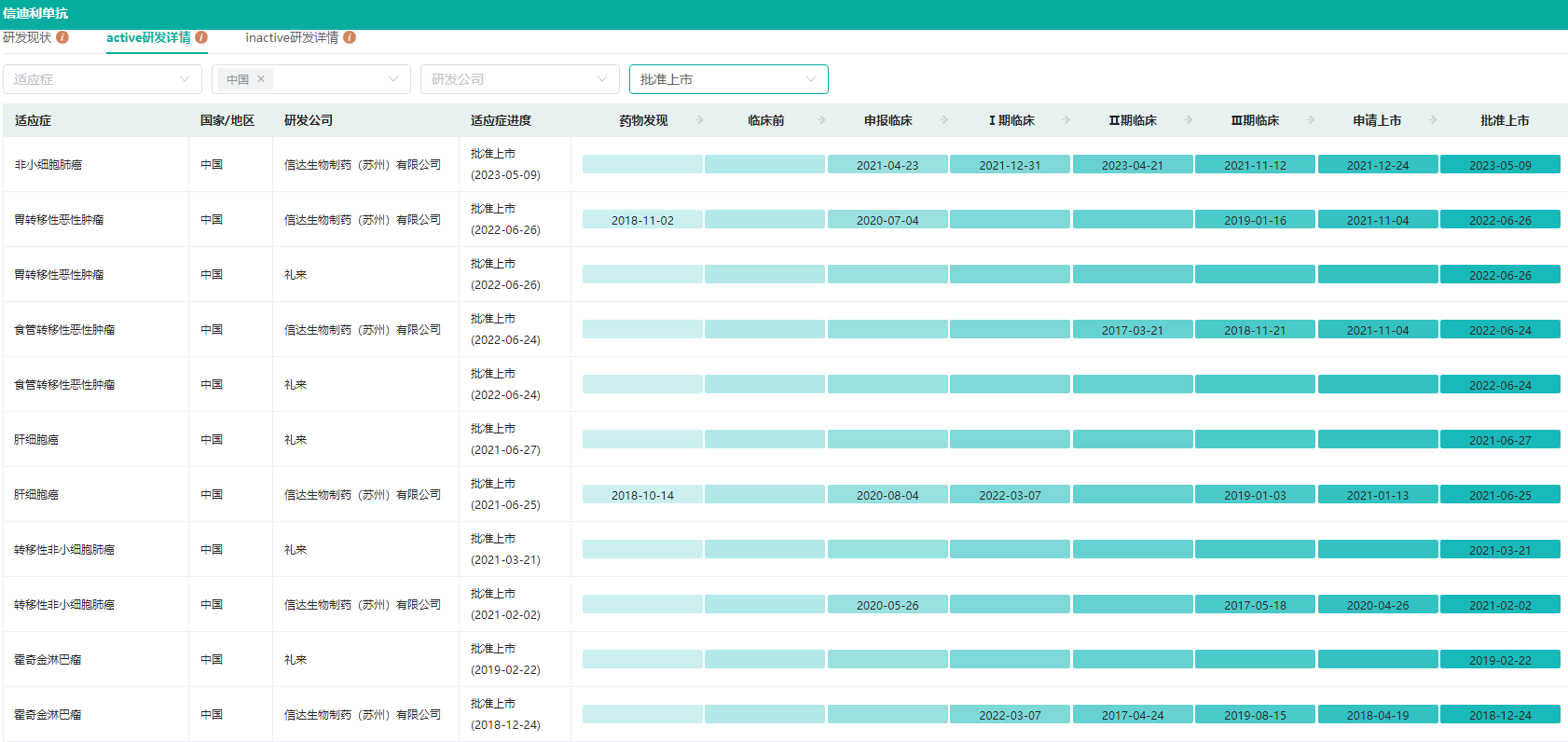
图片来源:药融云全球药物研发数据库
信迪利单抗是获批的第二款国产PD-1单抗,也是首个被纳入国家医保目录的PD-1单抗。药融云全国医院销售(全终端)数据库显示,2021年信迪利单抗在销售收入及销量上保持了强劲的增长,医院端市场销售规模达到28.87亿元,同比增长47.76%。
二、临床缓解率提高近3倍!杨森IL-23抑制剂3期临床结果积极
强生旗下杨森制药(Janssen)公司宣布,其IL-23抑制剂Tremfya(guselkumab)在治疗中度至严重的溃疡性结肠炎(UC)成人患者的3期临床试验QUASAR中获得积极中期结果。
Guselkumab是一款通过与IL-23受体的p19亚基结合,选择性抑制IL-23信号传导的人源化单克隆抗体,也是全球首个获批的靶向IL-23(p19)全人源单克隆抗体。临床数据显示,与安慰剂组相比,在接受治疗12周后Tremfya更多患者达到:临床应答(clinicalresponse,61.5%比27.9%,p<0.001);内镜改善(26.8%比11.1%,p<0.001);组织内镜粘膜改善(23.5%比7.5%,p<0.001)。
溃疡性肠炎是炎症性肠病(IBD)的一种,是一种影响结肠的慢性疾病。由于免疫系统的过度活跃反应,结肠内壁出现炎症,并且产生溃疡,患者症状包括持续腹泻、腹痛、便血、食欲不良、体重减轻和疲惫等。IL-23是炎症性疾病发病机制的重要驱动因素。
药融云数据库显示,Tremfya目前已在欧盟、美国、加拿大、韩国、日本等国家获得批准,用于治疗中重度斑块状银屑病成人患者及银屑病性关节炎。
Guselkumab全球研发进度查询

图片来源:药融云全球药物研发数据库
三、晚期三阴乳癌迎来超强助攻!先声再明公布曲拉西利2期临床数据
先声药业旗下聚焦抗肿瘤领域的创新药公司先声再明,在2023欧洲肿瘤学学会(ESMO)乳腺癌大会上宣布了其与G1Therapeutics合作开发的CDK4/6抑制剂科赛拉(曲拉西利),联合靶向TROP2的ADC药物拓达维(戈沙妥珠单抗)治疗转移性三阴性乳腺癌患者的2期临床初步数据(NCT05113966)。
其临床数据分析显示,相对于戈沙妥珠单抗此前公布的单药数据(ASCENT研究),中性粒细胞减少症、贫血等多种骨髓抑制事件明显减少,腹泻发生率降低50%以上。在总体人群中,试验组中位PFS为4.1个月。在目前5.5个月随访时间内,PD-L1阳性肿瘤患者客观缓解率(ORR)为35.3%,高于总体人群的ORR(25.0%)。
曲拉西利临床试验(NCT05113966)结果详情/招募信息
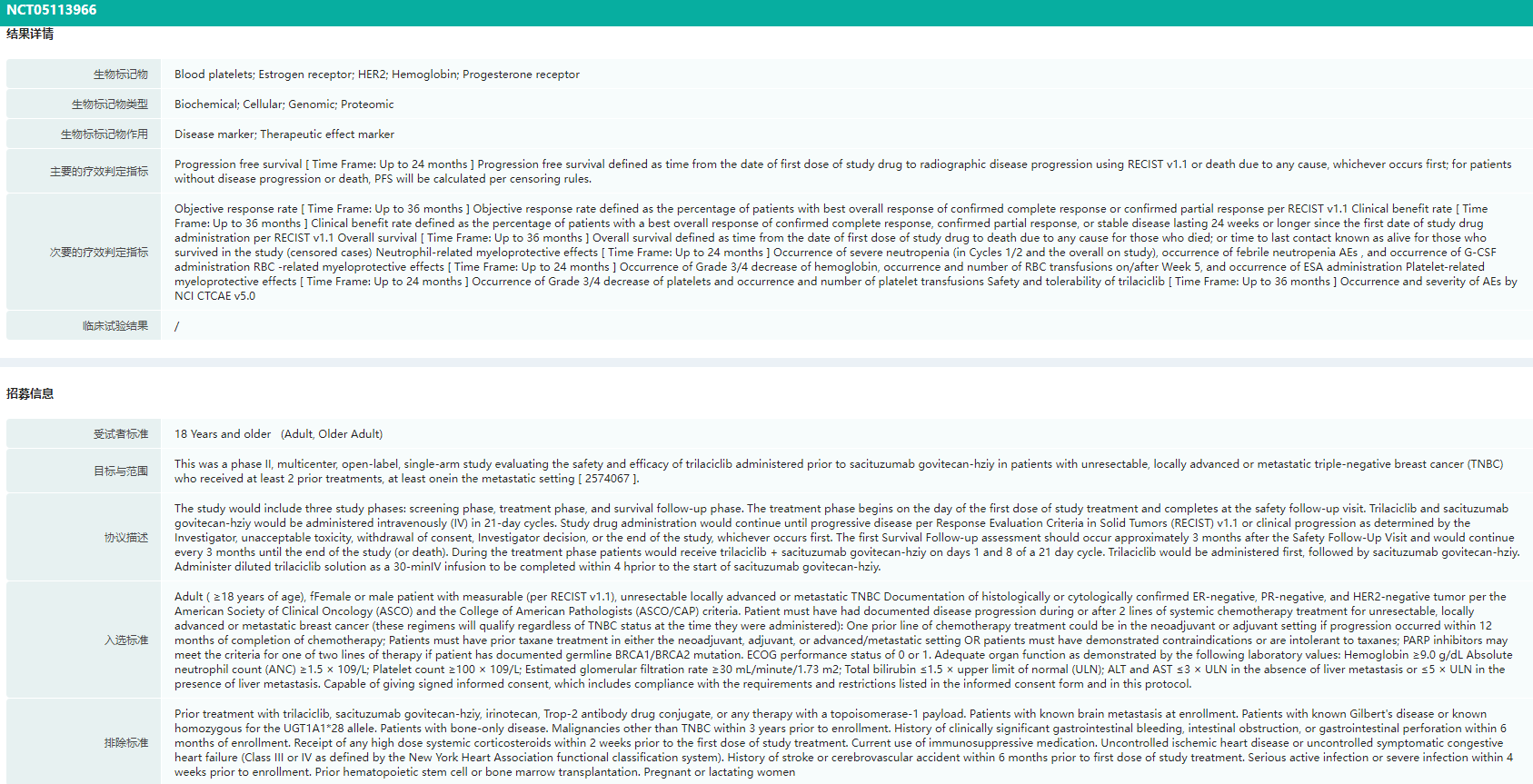
图片来源:药融云全球临床试验数据库
曲拉西利(Trilaciclib,商品名:Cosela)是一种高效、选择性、可逆的CDK4/6抑制剂,在化疗前预防性给药,可诱导骨髓造血干/祖细胞暂时停滞在细胞周期的G1期,减少暴露于化疗中的损伤。与细胞因子类药物不同,曲拉西利作用于骨髓抑制的源头,具有白细胞、红细胞、血小板3系的保护。同时,小细胞肺癌等肿瘤细胞对CDK4/6抑制剂不敏感,因此该药的使用不影响化疗的抗肿瘤疗效。
曲拉西利作为一款全系骨髓保护药物,有望作为ADC的伴侣,进一步提高患者对这种新型抗肿瘤治疗的耐受性。
四、神州细胞4价新冠疫苗国内III期临床取得积极结果
近日,神州细胞重组新冠疫苗4价S三聚体蛋白疫苗SCTV01E用于≥18周岁已完成基础免疫或加强免疫人群中接种加强免疫的国内III期临床达到主要研究终点。
SCTV01E已在国内疫情高峰时段开展随机、双盲、安慰剂对照的Ⅲ期临床研究,旨在评价在≥18周岁已完成新冠疫苗基础免疫或加强免疫人群中,接种1剂SCTV01E进行加强免疫的保护效力和安全性。
数据显示,1针SCTV01E加强免疫后14天至4个月,预防所有新冠病毒感染(含有症状和无症状感染者)的保护效力(VE)为82.4%(95%置信区间:57.9%,92.6%);预防有任何症状新冠病毒感染的保护效力为79.7%(95%置信区间:51.0%,91.6%)。此外,疫苗安全性良好。
SCTV01E全球临床试验查询(部分展示)
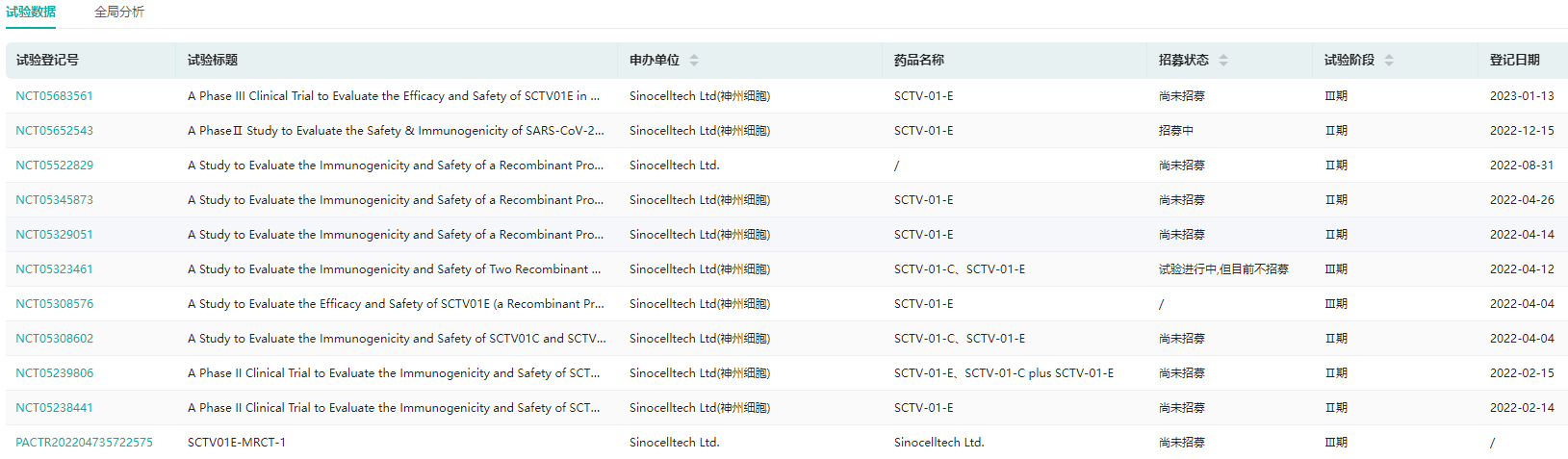
图片来源:药融云全球临床试验数据库
SCTV01E(商品名:安诺能®4)是神州细胞工程针对新冠病毒变异快、以原始株为基础的国内外第一代疫苗对变异株中和抗体滴度和保护率下降等问题自主研发的新一代4价变异株重组蛋白疫苗,也是全球首个四价新冠疫苗,临床上拟用于预防新型冠状病毒感染所致疾病。
SCTV01E的活性成分分别包含四种WHO认定的主要变异株阿尔法(Alpha)、贝塔(Beta)、德尔塔(Delta)和奥密克戎(Omicron-BA.1)的重组S三聚体蛋白抗原,并采用比传统铝佐剂更能显著增强Th1细胞的水包油新型佐剂。
药融云数据库显示,目前全球已获批附条件上市或紧急使用的新冠疫苗产品已超过50个,国内已有16款新冠疫苗获得国家药监局批准附条件上市或纳入紧急使用。
文章篇幅有限,在此抛砖引玉。想要获悉药融云《全球在研新药与靶点月报》完整干货内容,请关注“药融云公众号(yrydata)”,后台回复关键词“报告”进行领取;或者前往“药融文库(wenku.pharnexcloud.com/?mh)”网站「原创报告」栏目中进行全文下载。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论