解读新药研发最新进展与方向,剖析产品竞争格局与市场前景,洞察医药投融资市场特征与趋势,尽在药融云《全球在研新药与靶点月报》。据其数据统计,2023年5月共有152个化药1类新药受理号获CDE承办(含补充申请21个),其中国产109个,进口22个;从申请类型来看,包括临床申请128个,上市申请3个,涉及70个品种,82家企业。
5月共有95个1类治疗用生物制品受理号获CDE承办(含补充申请19个),其中国产61个,进口15个,从申请类型来看,包括临床申请72个,上市申请4个,涉及73个品种,79家企业。同时,本月有5个1类中药受理号获CDE承办,从申请类型来看,全部为临床申请5个,涉及5个品种,5家企业。
5月共有122款新药获批临床(共计210个受理号),其中包括62款化药,57款生物制品,3款中药;同时,本月有11款新药获批上市。
2023年5月国内获批上市的新药
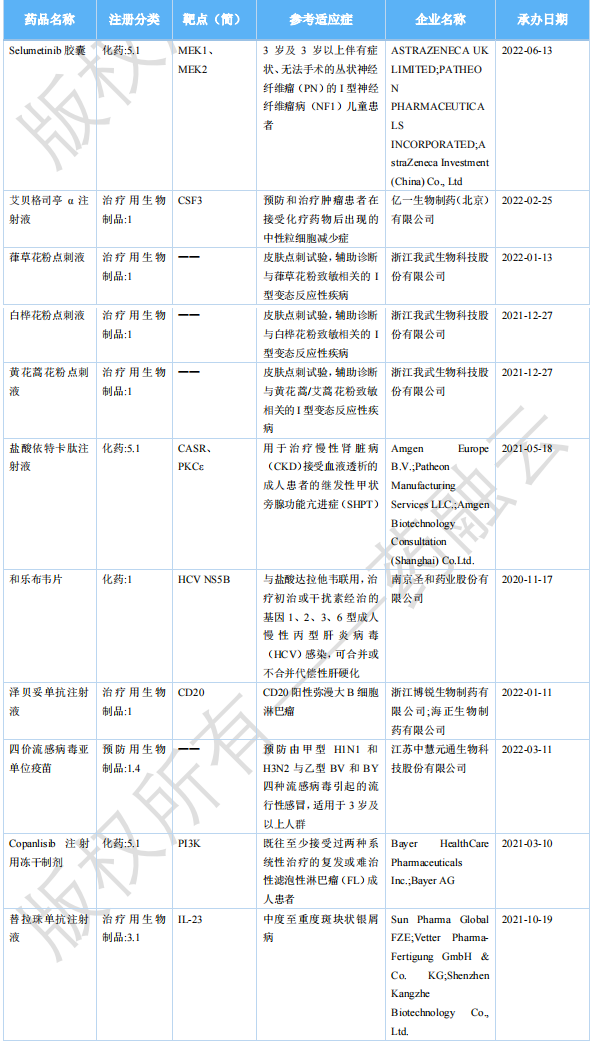
图片来源:药融云《全球在研新药与靶点月报》
想要获取药融云《全球在研新药与靶点月报》完整报告内容,请关注“药融云公众号(yrydata)”,后台回复关键词“报告”进行领取;或者前往“药融文库(wenku.pharnexcloud.com/?mh)”「原创报告」中进行全文下载。
一、硫酸氢司美替尼胶囊——全球首款应用于NF1的靶向药物
阿斯利康(AstraZeneca)申报的5.1类新药硫酸氢司美替尼胶囊(Selumetinib胶囊)获批上市,该药本次获批的适应症为:用于3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的1型神经纤维瘤病(NF1)儿科患者的治疗。
1型神经纤维瘤病(NF1)是由NF1基因突变所致的常染色体显性遗传病,全球发病率为1/2500-1/3000,其中50%的患者有家族史。20-50%的NF1表现为丛状神经纤维瘤(PN),PN是沿神经生长并累及神经多分支的良性神经鞘瘤,多数在儿童期被诊断并在此期间生长最快,且多数逐年增大,破坏肌肉组织、骨骼组织甚至内脏,引起疼痛、功能障碍、毁容和恶变等并发症。
Selumetinib(英文商品名:Koselugo,中文商品名:科赛优,通用名:硫酸氢司美替尼胶囊)是阿斯利康与默沙东共同研发的一款高效选择性、非ATP竞争性的MEK1/2抑制剂,而MEK是RAS-RAF-MEK-ERK信号通路的关键蛋白激酶。Selumetinib可择性地抑制MEK1和MEK2,达到NF1的治疗效果。
硫酸氢司美替尼胶囊获批进口耗时329天

图片来源:药融云中国药品审评数据库
药融云数据库显示,截至2023年5月8日,司美替尼成为中国首个也是唯一一个获批用于治疗3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤的I型神经纤维瘤病儿童患者的药物疗法。2020年4月,司美替尼获FDA批准上市,成为全球首款应用于NF1的靶向药物,用于治疗2岁及以上有症状、无法手术的丛状神经纤维瘤(属于1型神经纤维瘤)儿童患者。
目前,全球已获批上市的MEK1/2抑制剂有4款,除了阿斯利康的司美替尼(Selumetinib)外,还有百济神州/诺华的曲美替尼(Trametinib)、罗氏/伊克力西斯制药的考比替尼(Cobimetinib)、Array生物制药的比美替尼(Binimetinib)。
曲美替尼获批上市适应症查询

图片来源:药融云全球药物研发数据库
其中,曲美替尼于2019年12月在国内获批上市,批准达拉非尼与曲美替尼联合治疗BRAF V600突变阳性不可切除或转移性黑色素瘤。
药融云全球药物研发数据库显示,目前全球有近50款在研MEK1/2抑制剂,国内企业也在积极布局。其中,进度靠前的有复星医药的FCN-159、恒瑞医药的SHR-7390、正大天晴的TQ-B3234、基石药业的CS-3006等。
国内在研MEK1/2抑制剂查询(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
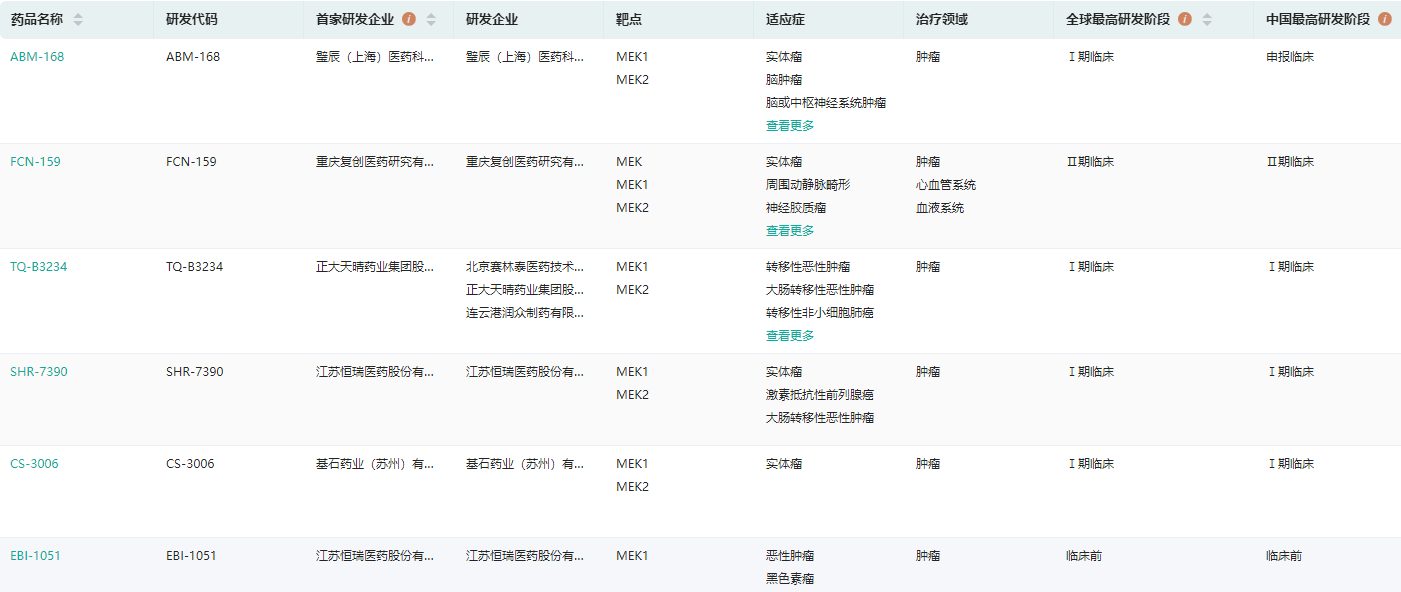
图片来源:药融云全球药物研发数据库
二、盐酸依特卡肽注射液——甲亢治疗新药
复星医药与安进合作授权的盐酸依特卡肽注射液获NMPA批准上市,用于治疗慢性肾脏病(CKD)接受血液透析的成人患者的继发性甲状旁腺功能亢进症(SHPT)。这是国内首个且唯一上市的静脉注射型拟钙剂。
药融云数据库显示,盐酸依特卡肽注射液先后于2016年11月和2017年2月,获得欧盟和美国FDA批准上市,用于治疗正接受血液透析治疗的成年慢性肾脏病患者的SHPT。
盐酸依特卡肽注射液是一种新型、长效拟钙剂,具有调节甲状旁腺主细胞表面钙敏感受体分泌甲状旁腺的作用,从而降低甲状旁腺激素(PTH)水平。
盐酸依特卡肽注射液获批进口审评时间轴查询
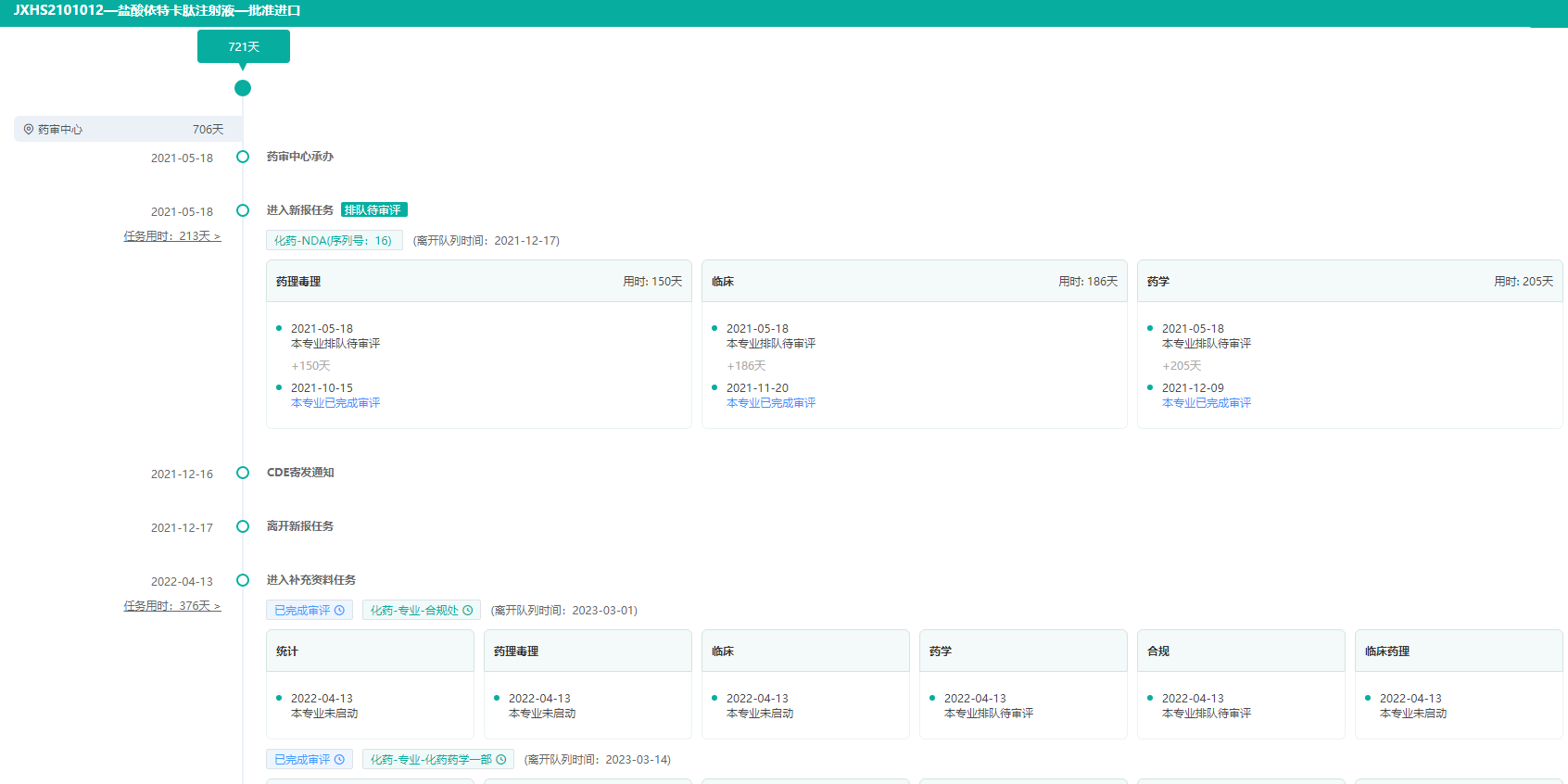
图片来源:药融云中国药品审评数据库
慢性肾脏疾病(CKD)是常见多发病,患者早期症状比较隐蔽,到终末期肾衰时才会出现严重症状,重度及终末期肾病患者需要肾透析治疗才能挽救生命。SHPT是CKD患者维持血液透析的常见并发症之一,在CKD患者中往往是慢性代偿性的。在我国的血液透析患者中,SHPT发病率为47%-58%。
三、艾贝格司亭α注射液——国内首个第三代双分子升白针
亿帆医药子公司亿一生物(EviveBiotech)申报的艾贝格司亭α注射液上市申请获得批准,用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染发生率。
中性粒细胞减少症是放化疗引起的最常见的血液学毒性:25%~40%化疗初治患者会出现中性粒细胞减少;超过60%患者化疗延迟和减量首要原因是中性粒细胞减少;剂量改变患者中有超过60%再次出现中性粒细胞减少。中性粒细胞减少症的减少程度和持续时间与患者感染风险甚至死亡风险密切相关。
艾贝格司亭α注射液(商品名:亿立舒)是一种新型长效粒细胞集落刺激因子(G-CSF),可刺激中性粒细胞前体的增殖分化和成熟中性粒细胞的释放,从而增强癌症患者免疫系统能力;艾贝格司亭α是国内首个采用Fc融合技术的G-CSF药物,即国内首个第三代双分子升白针。
艾贝格司亭α注射液批文(国药准字S20230026)信息
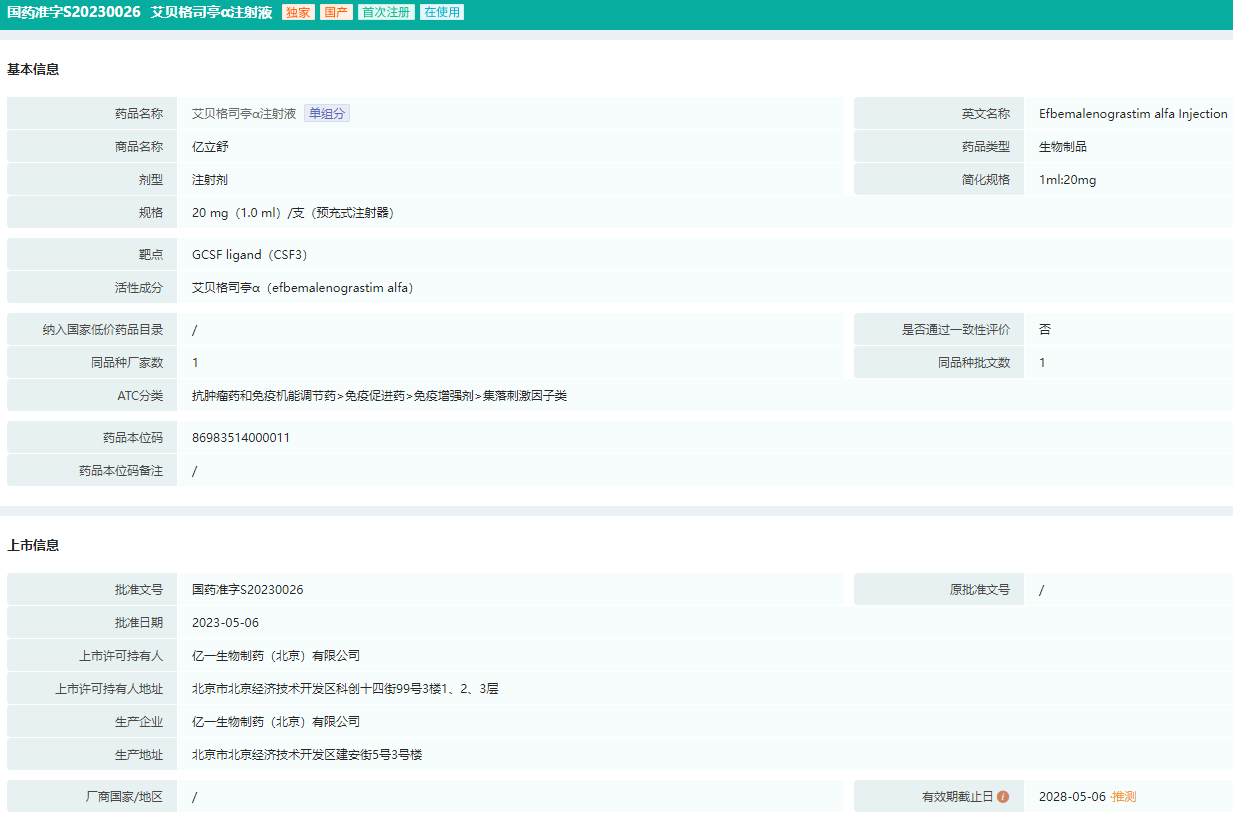
图片来源:药融云中国药品批文数据库
中性粒细胞是血液白细胞的一种,在非特异性免疫系统中有着非常重要的作用。中性粒细胞减少症严重影响肿瘤患者的临床治疗和生存,G-CSF是当前最常见的预防、治疗放化疗相关中性粒细胞减少的药物。艾贝格司亭α注射液的上市,为国内化疗患者的减负带来了新希望,助力肿瘤患者顺畅渡过化疗难关。
四、我武生物3项点刺液品种批准上市
我武生物的“黄花蒿花粉变应原皮肤点刺液”、“白桦花粉变应原皮肤点刺液”、“葎草花粉变应原皮肤点刺液”3项点刺液品种上市许可申请获得批准,满足更多过敏性疾病患者的过敏原检测需求。
过敏原皮肤点刺实验(skinpricktest,SPT)是皮肤试验的一种,是临床筛查IgE介导的超敏反应最有效的方法,广泛应用于确定由各种自然物质引起的临床致敏,如吸入或食入致敏源。
过敏性疾病,是全球最主要的慢性病之一,超过20%的人群都受此困扰。主要的过敏性疾病包括过敏性鼻炎、过敏性哮喘、过敏性皮炎、过敏性紫癫、过敏性休克等。其中最为常见的就是过敏性鼻炎,在我国整体患病率目前已达到17.6%,终端患者人数在2.4亿左右,并且仍在呈现上升趋势。
我武生物研发管线查询
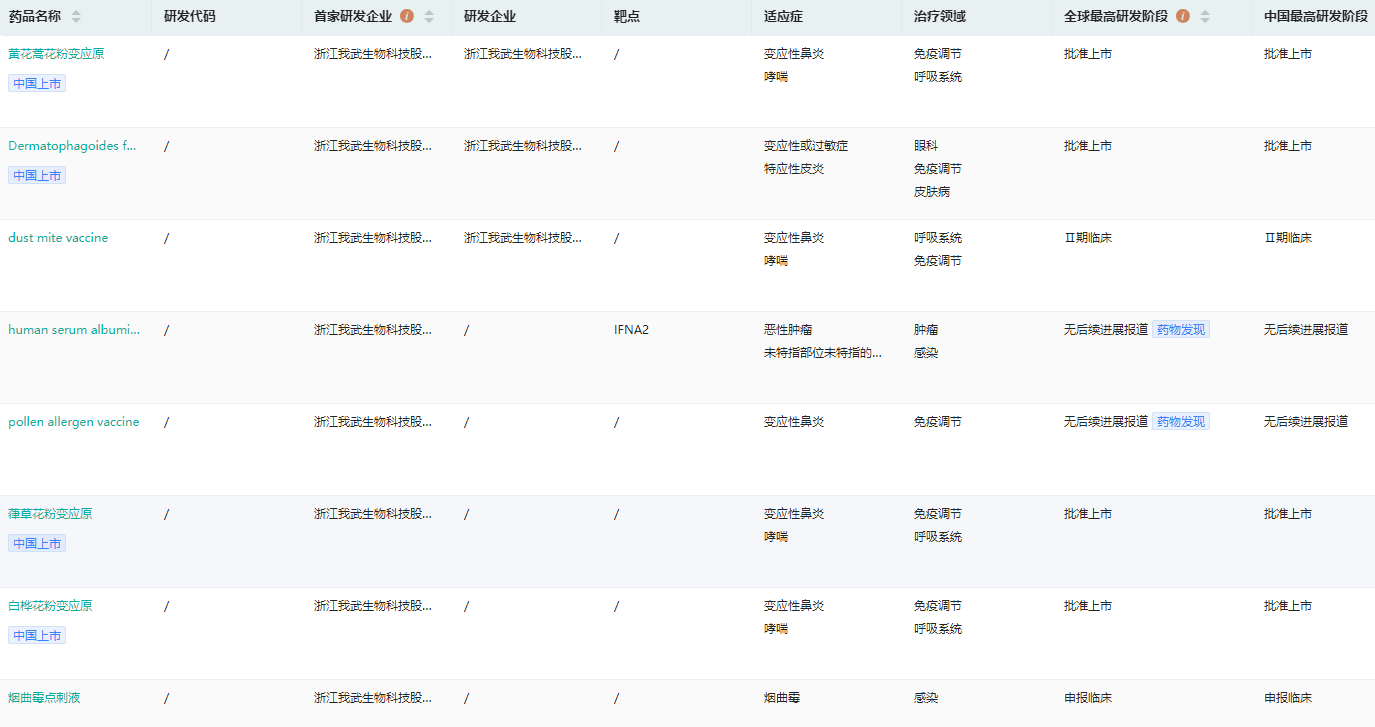
图片来源:药融云全球药物研发数据库
我武生物脱敏药物系列产品的开发,不仅给过敏患者带来安全有效的舌下脱敏治疗方式,更填补了舌下脱敏药物及过敏原皮肤点刺诊断试剂在国内市场的空白。其核心产品粉尘螨滴剂,用于粉尘螨过敏引起的过敏性鼻炎、过敏性哮喘的脱敏治疗,在脱敏药物市场占有率中排名第一。
五、泽贝妥单抗注射液——1类创新型生物制品
浙江博锐生物的1类创新型生物制品泽贝妥单抗注射液(商品名:安瑞昔)获批上市,用于CD20阳性弥漫大B细胞淋巴瘤,非特指性(DLBCL,NOS)成人患者,应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、泼尼松)联合治疗。
泽贝妥单抗注射液为针对B细胞表面CD20抗原的人-鼠嵌合型单克隆抗体,可特异性结合B细胞表面的CD20抗原,从而启动B细胞溶解的免疫反应,发挥抗肿瘤作用。其临床前研究数据显示,相比其他产品,泽贝妥单抗的抗体介导的细胞毒性效应更强,并具有更大的稳态分布容积,能够对B细胞产生更持久的清除作用,从而发挥更好的药物作用。
药融云数据库显示,除此之外,上海医药、传奇生物、正大天晴、齐鲁制药、君实生物、百奥泰、嘉和生物等国内企业也在布局CD20靶点相关药物,涉及单特异性抗体、双特异性抗体、抗体偶联药物、CAR-T等多种成分类别。
国内布局CD20靶点企业研发进度查询
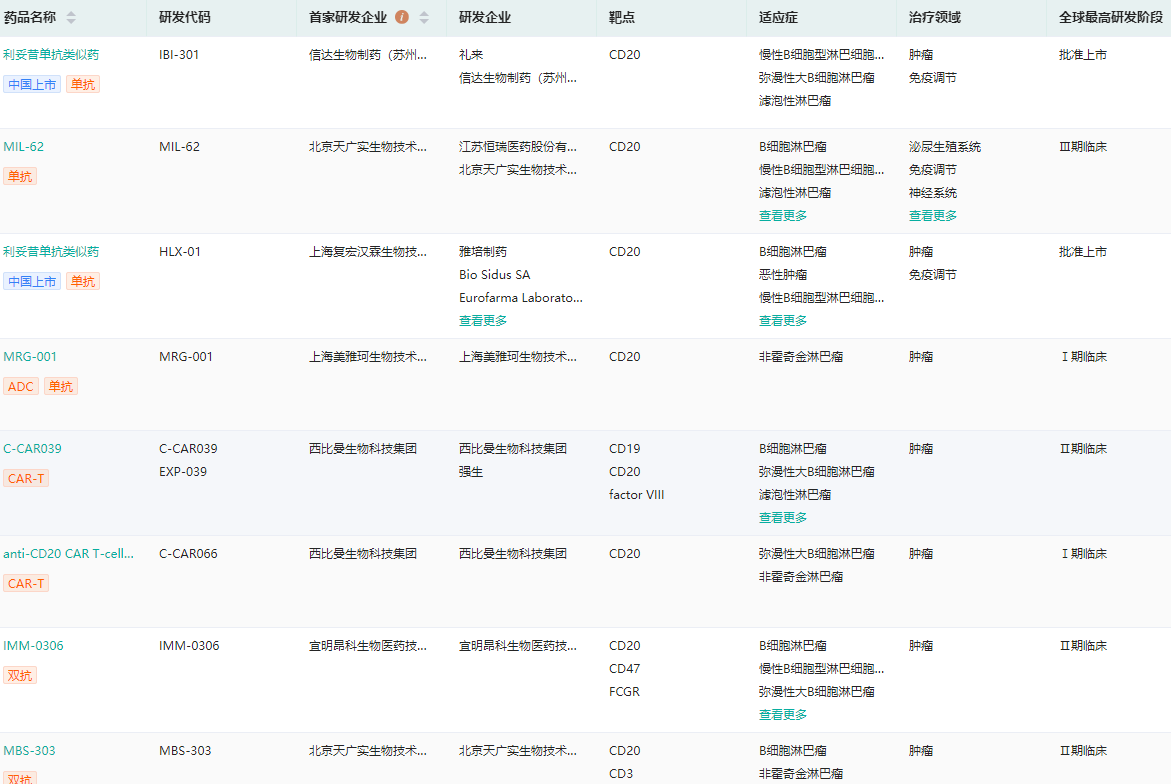
图片来源:药融云全球药物研发数据库
六、和乐布韦片——治疗丙型肝炎病毒感染
南京圣和药业自主研发的1类抗HCV新药和乐布韦片(商品名:圣诺迪)获批上市,用于与盐酸达拉他韦联用,治疗初治或干扰素经治的基因1、2、3、6型成人慢性丙型肝炎病毒(HCV)感染,可合并或不合并代偿性肝硬化。
奥磷布韦片是国内首个HCV NS5B聚合酶抑制剂,奥磷布韦片通过肝脏代谢,转化为非天然核苷三磷酸,非天然核苷三磷酸与丙型肝炎病毒(HCV)复制所需的泛基因型非结构蛋白5B(NS5B)聚合酶发生竞争性结合,“假扮”成病毒复制时需要的天然核苷三磷酸掺入到HCV RNA链中,形成错误的病毒RNA模板,导致病毒RNA链的延长提前终止,HCV的复制也因此终止。
七、Copanlisib注射用冻干制剂
拜尔公司的Copanlisib注射用冻干制剂上市,用于治疗既往至少接受过两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。
Copanlisib(英文商品名:Aliqopa)是一种通过静脉注射的磷脂酰肌醇-3-激酶(PI3K)抑制剂,对于在恶性B细胞中表达的PI3K-α和PI3K-δ两种亚型都具有抑制活性,可通过细胞凋亡和抑制恶性B细胞的增殖来诱导肿瘤细胞死亡。
药融云数据库显示,2015年Copanlisib获得美国食品药品监督管理局孤儿药,并获得快速通道和优先审评。2017年9月,Copanlisib获得美国FDA加速批准,用于治疗罹患复发性滤泡性淋巴瘤。
Aliqopa首次批准信息/NDC目录信息

图片来源:药融云美国FDA批准药品数据库
八、替拉珠单抗注射液——治疗中度至重度斑块状银屑病
康哲药业引进的替拉珠单抗注射液获批上市,用于治疗中度至重度斑块状银屑病成人患者。银屑病是一种免疫相关的慢性、复发性、炎症性、系统性疾病,我国有超过650万名银屑病患者。因疾病尚无法治愈,患者需长期遵循规范合理的治疗方案以获得良好的病情控制,达到皮损全清。替拉珠单抗注射液是一种人源化的lgG1/k单抗,通过选择性地与IL-23的p19亚基结合,抑制其与IL-23受体相互作用,从而抑制促炎症细胞因子和趋化因子的释放。
九、四价流感病毒亚单位疫苗——国内首创首款
江苏中慧元通生物研发的四价流感病毒亚单位疫苗(商品名:慧尔康欣)获批上市,是我国首款四价流感病毒亚单位疫苗,属预防用生物制品1类新药,用于预防由甲型H1N1和H3N2与乙型BV和BY四种流感病毒引起的流行性感冒,适用于3岁及以上人群。
作为新一代技术路线的流感疫苗,四价流感病毒亚单位疫苗具备有效抗原含量高、安全性高的优势,在不良反应率更低的同时,能产生更强的保护作用,尤其对老年人、儿童等体弱人群更为友好。
四价流感病毒亚单位疫苗获批生产耗时432天

图片来源:药融云中国药品审评数据库
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论