引言:
又到了每周的CDE周报时间,那么上周(2022年1月10-16日)的创新药、改良型新药承办情况如何呢?详情见下(文中统计结果不包括补充申请&进口再注册)。
创新药承办情况
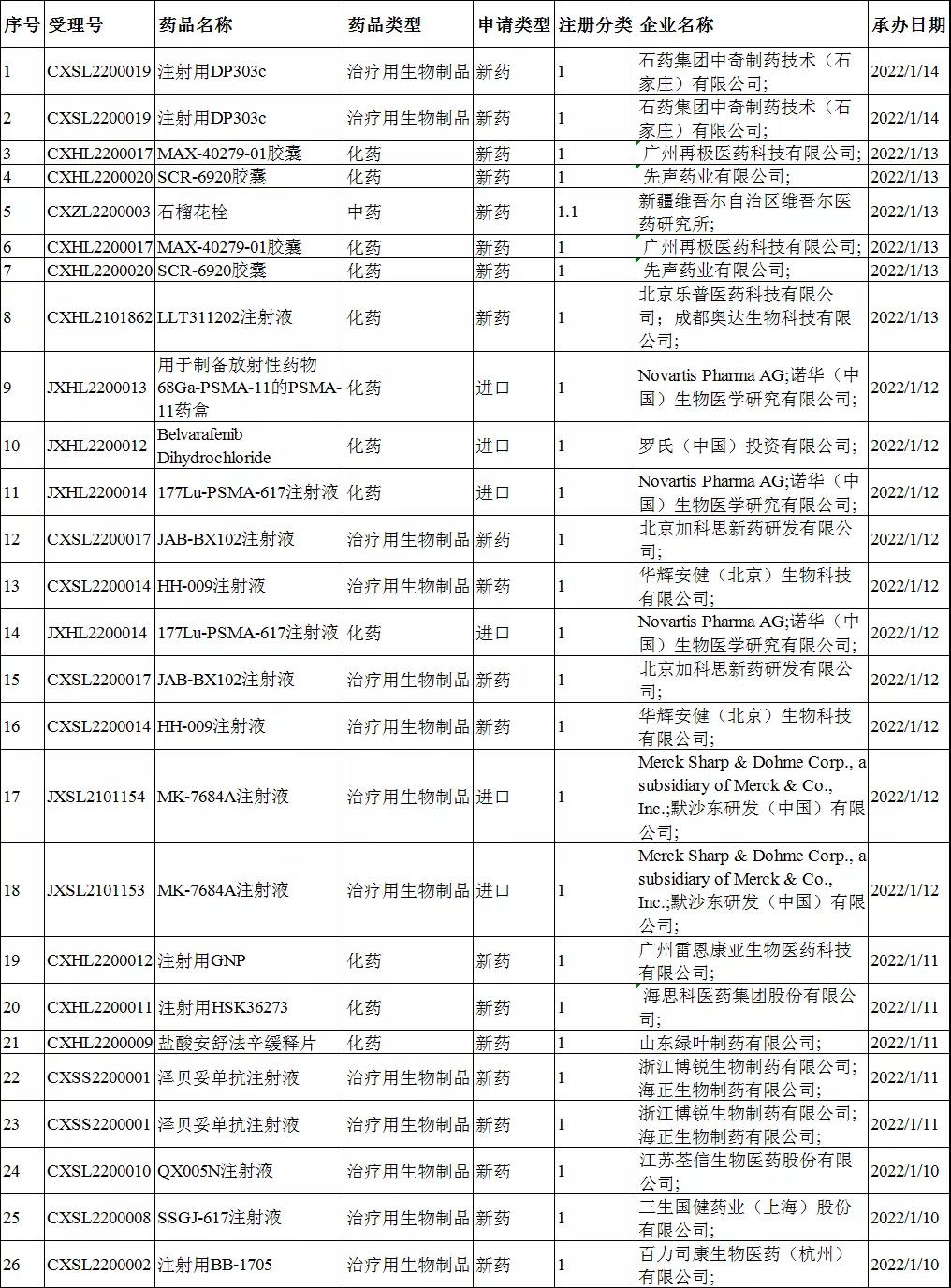
上周CDE共承办26个创新药受理号,其中包括了化药受理号12个,生物制品受理号13个,1个中药受理号。
在26个受理号中,有24个临床试验申请、有2个上市注册申请。
2个上市注册申请均为泽贝妥单抗注射液(浙江博锐生物制药有限公司;海正生物制药有限公司;)的上市注册申请。根据博锐生物新闻稿,泽贝妥单抗是该公司自主开发的新型抗CD20单抗,本次申报的适应症为初治CD20阳性弥漫大B细胞性淋巴瘤(DLBCL)。
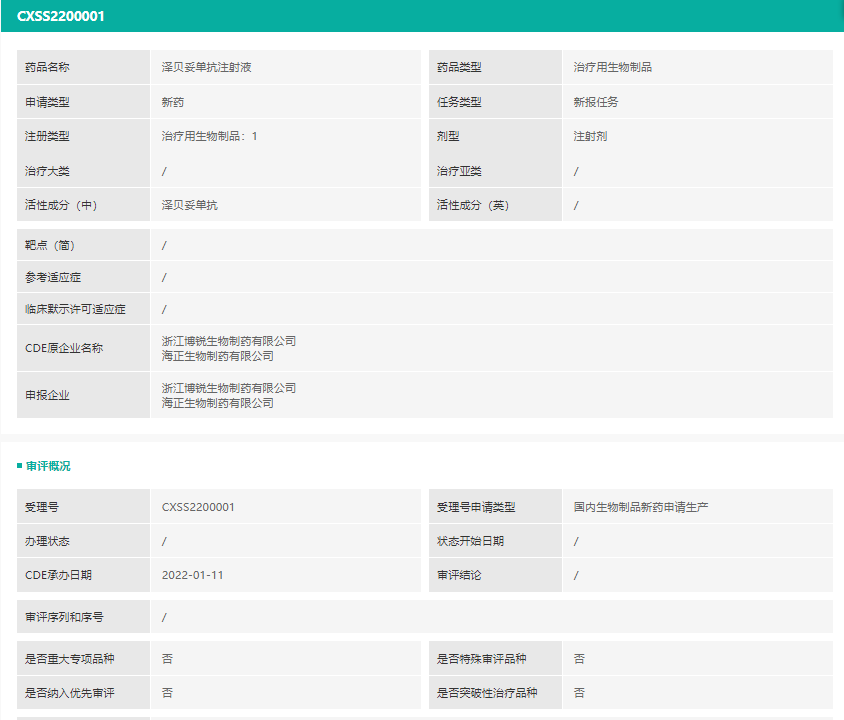
截图来源:药融云中国药品审评数据库
26个受理号中,国产药品受理号20个,进口药品受理号6个。
创新药承办情况
改良型新药承办情况
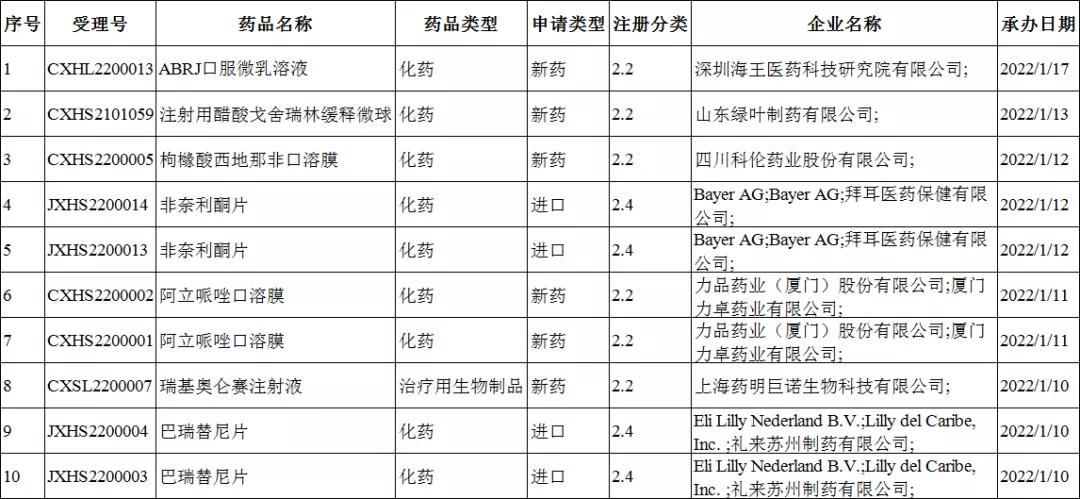
2022年1月10-16日CDE共承办10个改良型新药受理号,其中包括了化药受理号9个,生物制品受理号1个,无中药受理号。
其中,值得关注的是力品药业关于阿立哌唑口溶膜的上市注册申请。根据CDE过往承办数据,第一家被承办上市注册申请的阿立哌唑口溶膜产品的企业为齐鲁制药。目前并没有成功上市的阿立哌唑口溶膜产品,大多为片剂或口崩片。
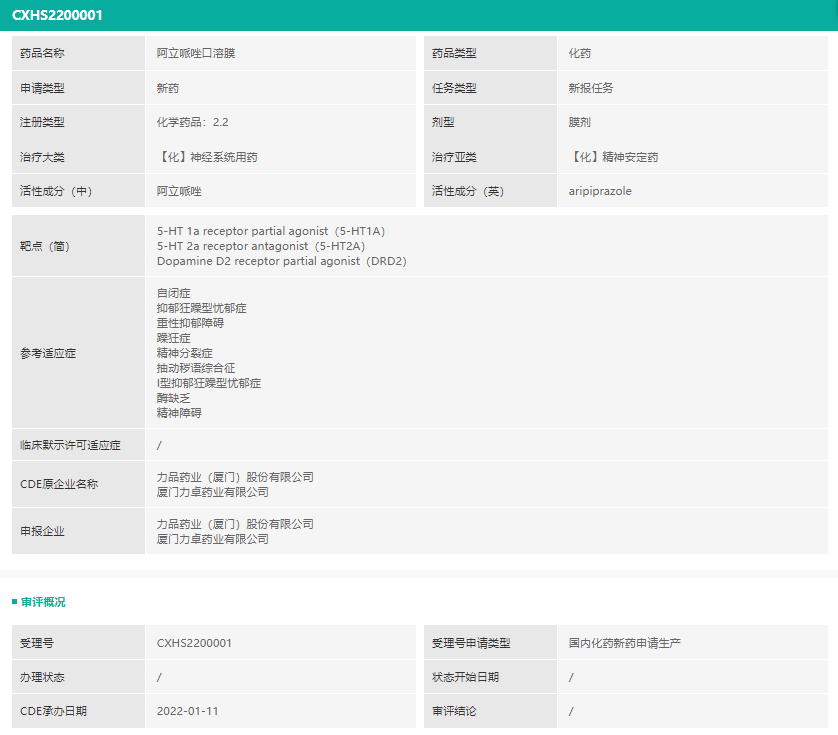
截图来源:药融云中国药品审评数据库
唯一的生物制品类改良型新药为:瑞基奥仑赛注射液(上海药明巨诺生物科技有限公司)。倍诺达(瑞基奥仑赛注射液)是药明巨诺在巨诺医疗(一家百时美施贵宝的公司)的CAR-T细胞工艺平台的基础上,自主开发的一款靶向CD19的自体CAR-T细胞免疫治疗产品。

截图来源:药融云中国药品审评数据库
在此次承办的改良型新药名单中,有8个为上市注册申请,仅有2个临床试验申请。
改良型新药承办情况
一致性评价承办情况
2022年1月10-16日CDE共承办31个一致性评价受理号,详情见下表。
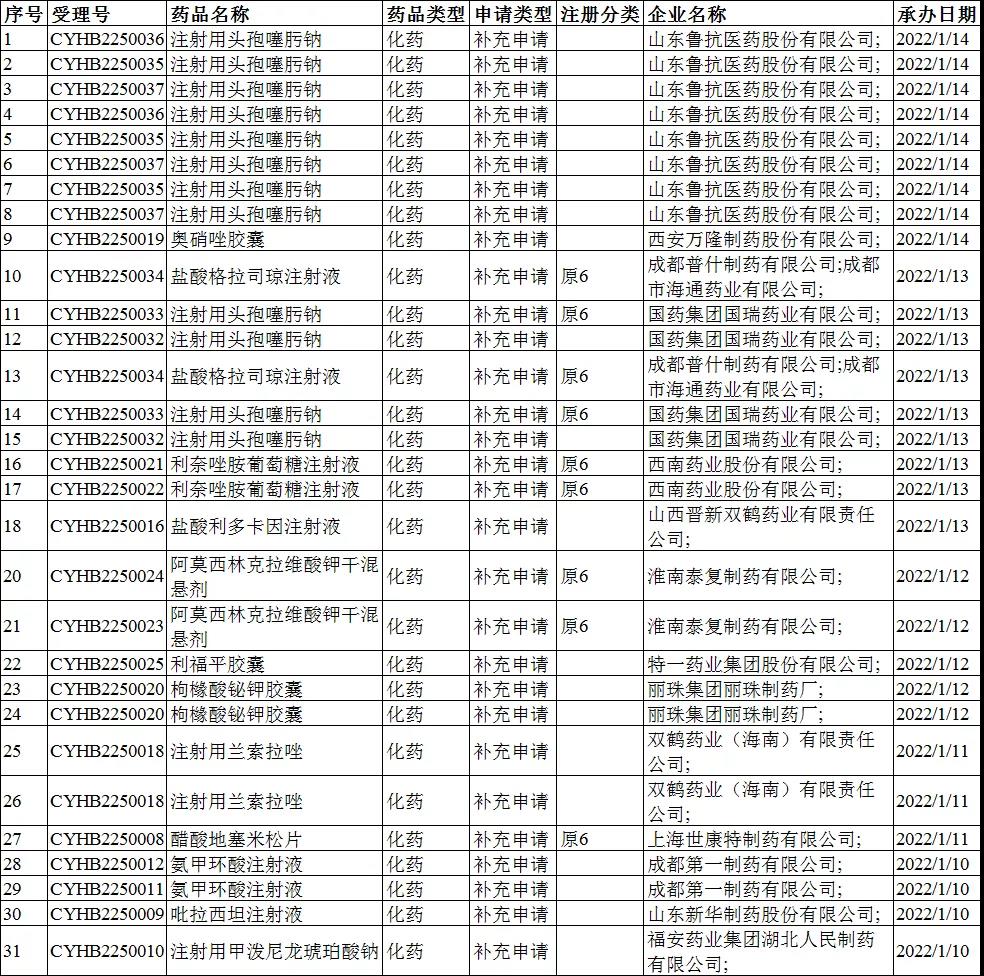
注册分类:3类
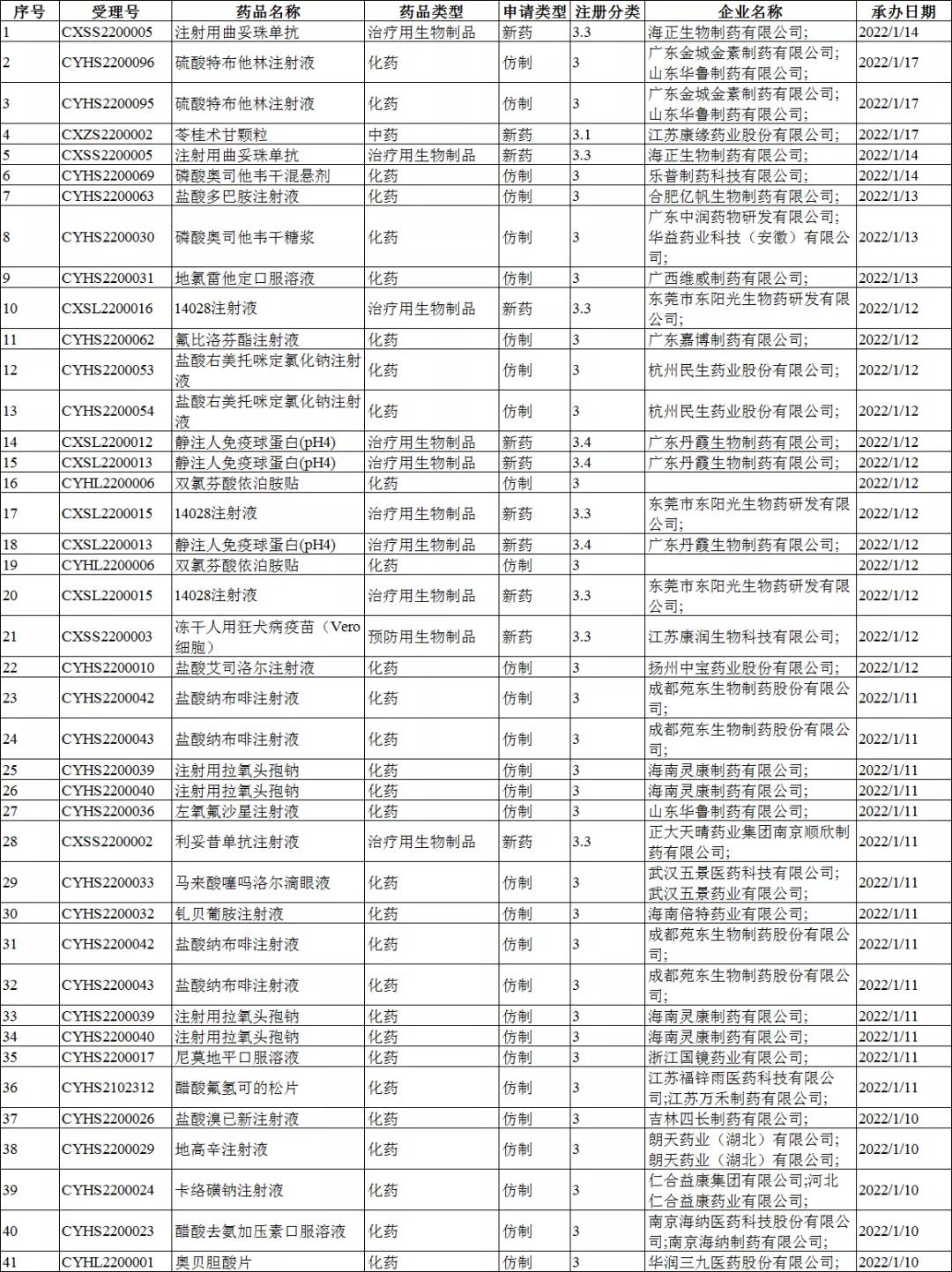
注册分类:4类

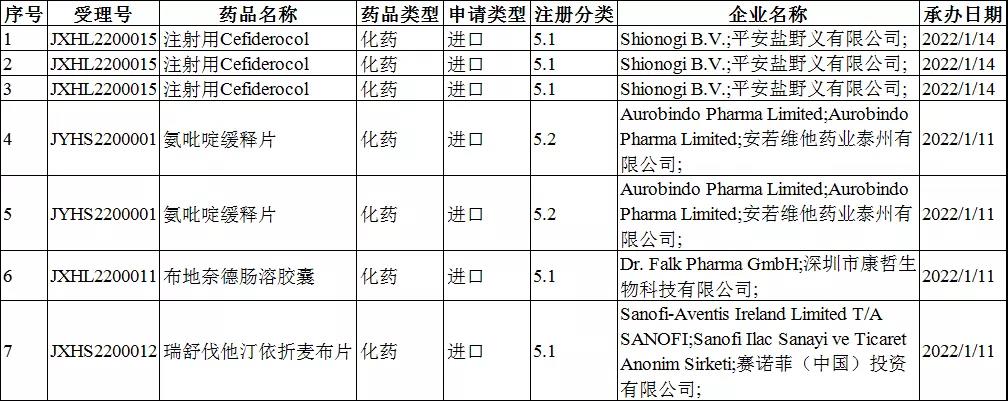
注册分类:5类






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论