5月25日,石药集团公布两项新药临床进展,一项仿制药上市批准。
全人源抗体药物NBL-015的IND申请已获美国FDA批准;
高选择性CDK9抑制剂SYHX1903片在中国获批开展临床试验;
- 利格列汀片(5mg) 获得国内的注册批准,并视同通过一致性评价。
临床批件
2021年至今,石药获得的临床批件共10个,8款1类新药在中国获批;3款新药在美国获批,为NBL-015、JMT601和NBL-012,详见下图。
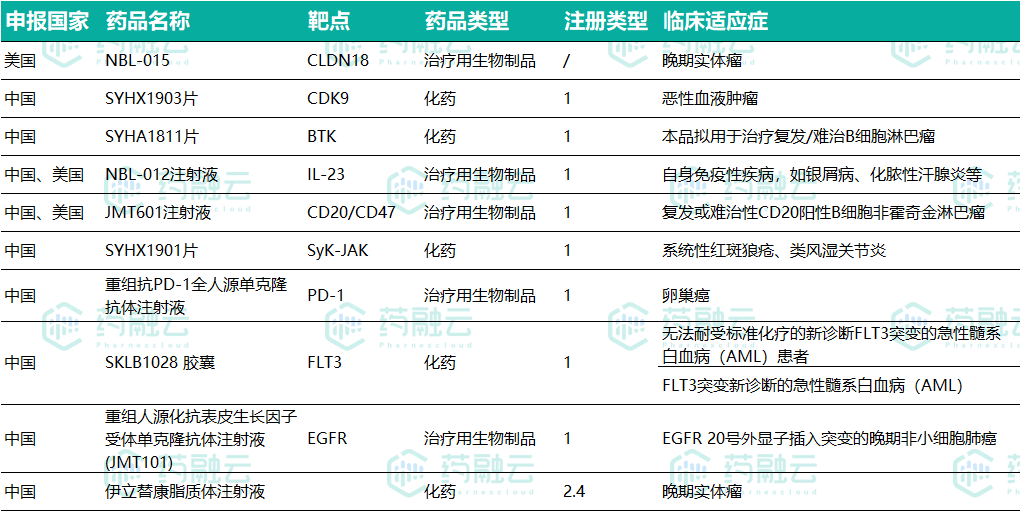
NBL-015获美国FDA临床批件
NBL-015是一种全人源抗Claudin 18.2单克隆抗体,用于治疗Claudin 18.2阳性表达的晚期实体瘤,包括胰腺癌、胃部、食道或食道胃结合部腺癌。此I期临床试验将会评估NBL-015对晚期实体瘤患者的安全性、耐受性和药代动力学特性。NBL-015之前已获美国FDA颁发针对治疗胰腺癌和胃癌的孤儿药资格认定。
Claudin 18.2是一个高度特异性的细胞表面分子,在胃部和胰腺肿瘤中广泛表达。在正常组织中,Claudin 18.2仅表达在分化的胃黏膜上皮细胞上,但不存在于胃干细胞区,故开发针对Claudin 18.2的治疗性抗体具有高度抗癌潜力。
NBL-015经过蛋白工程优化,具有增强的ADCC、CDC和ADCP效应。临床前体外细胞杀伤实验和肿瘤小鼠模型中显示NBL-015较同类药物具有免疫原性低、安全性高、亲和力强及抗肿瘤活性高的显着优势,有望成为治疗胰腺癌和胃癌的同类最佳靶向药物。
SYHX1903获中国临床试验批件
SYHX1903为一种高选择性的周期蛋白依赖的蛋白激酶9(CDK9)抑制剂,在以CDK9为靶点的恶性血液瘤和实体瘤治疗方面具有巨大的潜力。本次获批临床试验的适应症为恶性血液肿瘤,石药集团将计划申请晚期实体瘤适应症的临床试验。
临床前研究显示,该产品通过高选择性抑制CDK9,对恶性血液瘤和实体瘤有显著药效,同时具有良好的安全性和药代动力学特点,极有希望在临床研究中展现出良好的抗肿瘤治疗效果。
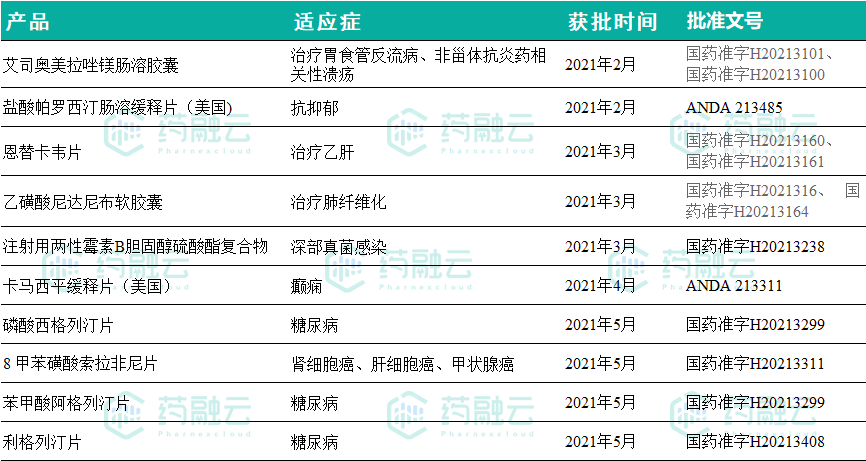
上市批准
2021年至今,石药集团获得的上市批准批件共10个,均为仿制,8款在中国获批;2款在美国获批。详见下图
根据石药集团发布的Q1业绩宣讲资料,收入同比增长9.9%至67.34亿元,扣非归母净利润同比增长63.3%至14.72亿元。恩必普1季度收入同比增长8.7%至15.8亿元。肿瘤药1季度20%同比增长达18.7亿元收入。研发费用投入人民币6.91亿元,同比增长21.7%。
共有约300个在研产品,其中约100个为创新药产品,未来三年预计上市新产品60个,其中预计市场空间超过人民币10亿元的重磅品种将不少于15个,米托蒽醌脂质体,多西他赛白蛋白纳米粒,紫杉醇白蛋白纳米粒(速溶)等产品都具有全球专利及极具市场价值的重磅产品。
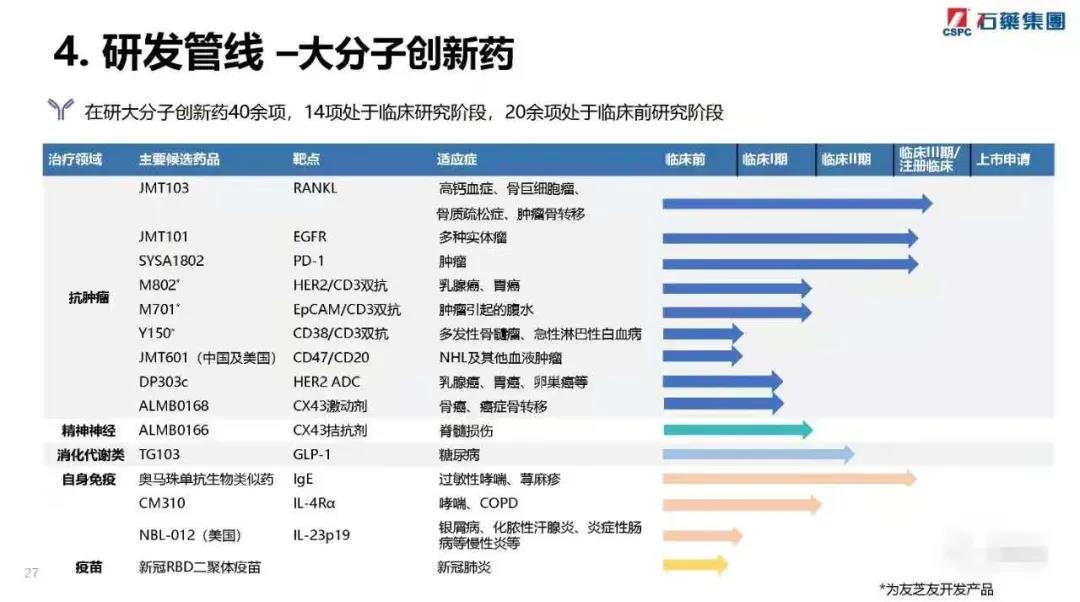
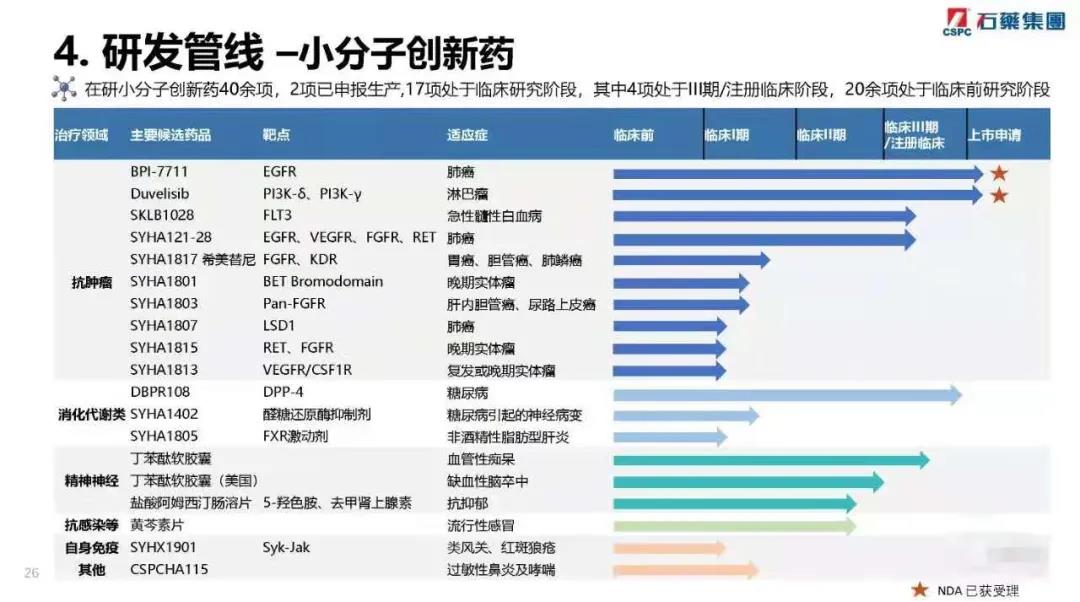
创新药上市计划
下半年米托蒽醌脂质体有望获批上市。
2022年, PI3K抑制剂、 3代EGFR 、两性霉素B脂质体有望获批。
2023年开始,公司预计每年会有5-8个创新药获批,包括双抗、 ADC等新技术平台上的产品。
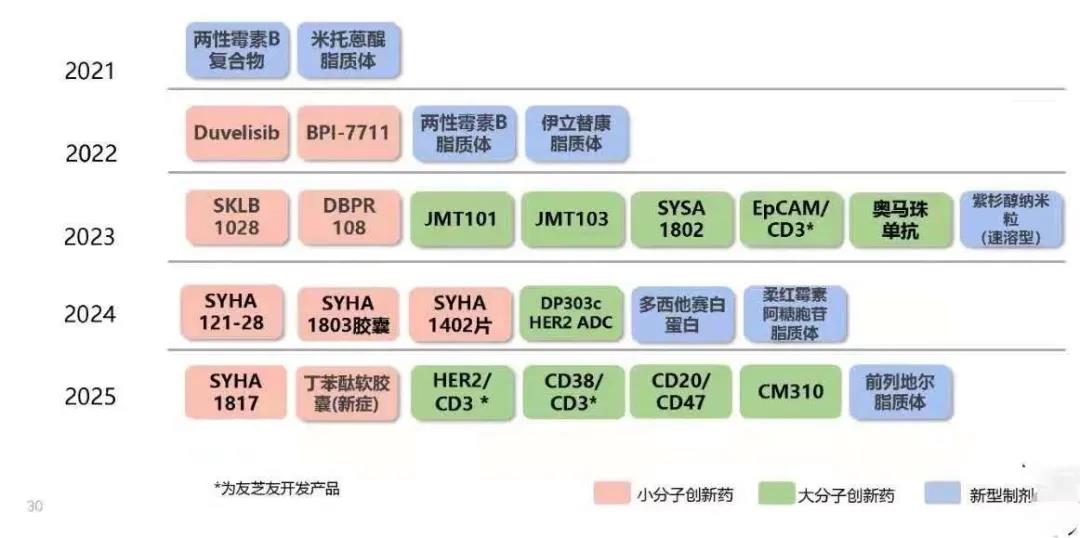
创新药的IND计划
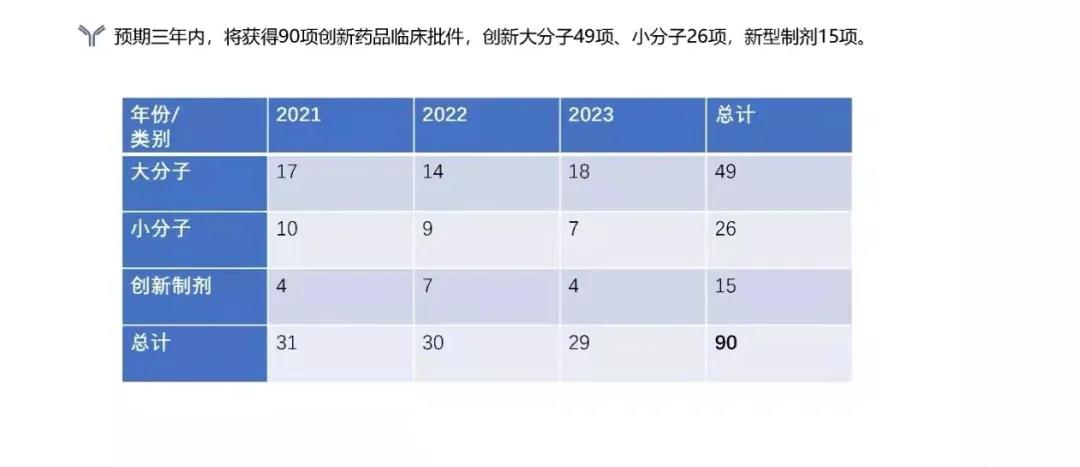
预期三年内,将获得90项创新药品的临床批件,创新大分子49项,小分子26项,新型制剂15项。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论