声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及);本文不构成任何投资建议。
据RTTNews报道,近期,Allogene Therapeutics宣布,在收到ALPHA2研究中治疗的一名患者的ALLO-501A CAR T细胞染色体异常的报告后, FDA暂停了该公司的 AlloCAR T 临床试验。
受该消息影响,Allogene Therapeutics, Inc. (ALLO) 的股价在周四的延长交易时段下跌了 40% 以上。
该公司表示,在与FDA协商后,将在未来几周内提供更多更新(数据)。FDA将继续积极审查为关键的ALLO-501A Phase 2临床而提交的Phase 1的资料。
“患者安全是我们的重中之重,我们致力于与 FDA 密切合作以评估这一发现的任何潜在临床意义,并确定推进 ALLO-501A 和我们的临床项目的下一步,”研发执行副总裁和首席医学官Rafael Amado说。“作为异体细胞疗法的先行者,我们认识到我们有额外的责任全面评估我们疗法的各个方面以推动该领域的发展。我们感谢与患者群体、临床研究人员、我们的科学顾问委员会和 FDA 的合作,我们正在努力了解这一发现的临床意义,并支持开发用于癌症的异体 CAR T 疗法。”
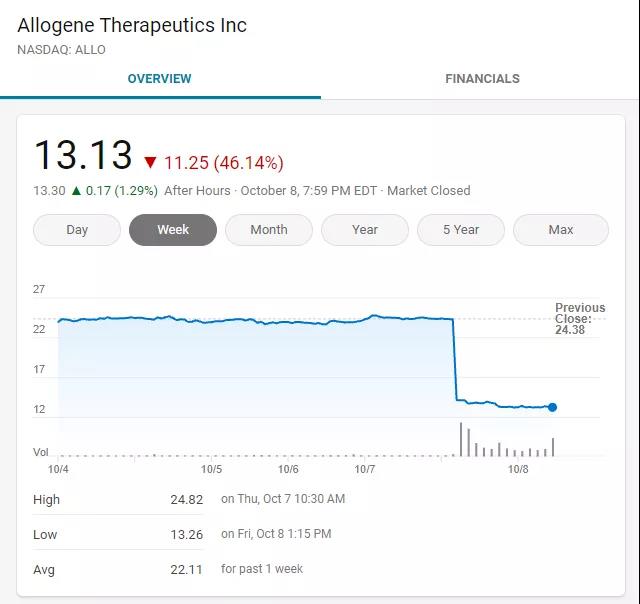
截图自MSN Money
关于CAR-T疗法
目前上市的Car-T疗法,为来自患者本身的T细胞进行工程化,用于其肿瘤的治疗。制造CAR-T细胞的传统技术包括:1)通过单采分离患者的T细胞(自体);2)将回收的细胞运送到一个中心生产基地;3)对其进行基因改造以表达CAR;4)在实验室中进行扩增;5)将CAR-T细胞送回医院,注入患者体内。这种方法制备周期长、成本高。受到患者自身T细胞质量影响大,CAR-T细胞增殖较弱、扩增有限和持续性差。
异体供体或通用型T细胞治疗,就具有了更多优势。可以提前进行工业制备,现货供应,将大大降低价格并缩减供货周期。面临的挑战,除了伦理上问题外,还有技术上的,包括需要克服移植物抗宿主病GVHD和受体对异基因T细胞的排斥反应。
参考来源:
--MSN Money
--Allogene Therapeutics Tanks 40% After FDA Puts Clinical Hold On Cancer Drug Trial, https://www.nasdaq.com/articles/allogene-therapeutics-tanks-40-after-fda-puts-clinical-hold-on-cancer-drug-trial-2021-10
--小药说药,CAR-T细胞治疗的挑战






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论