
2024年9月10日,专注于遗传性疾病的BridgeBio Pharma宣布了公司在研的AAV5基因疗法BBP-631用于治疗先天性肾上腺皮质增生症(CAH)的1/2期开放标签ADventure研究的初步结果。鉴于试验结果未达到目前需要追加资本投资的门槛,公司表示将不会继续推进该试验,此外将继续监测于2021年开始的这项研究中的八名入组患者,目前没有与治疗相关的严重不良事件报告。

这项1/2期开放标签ADventure研究旨在评估BBP-631在典型CAH成人患者中的安全性、耐受性和药效学活性。迄今为止,该研究的主要结果包括:
· 所有患者在服用较大剂量时,内源性皮质醇分泌均有所增加。在两个最高剂量水平的ACTH刺激试验后,与基线相比的最大变化分别为4.7 μg/dL 和 6.6 μg/dL,皮质醇水平高达11μg/dL。
· 11-脱氧皮质醇(21-羟化酶的产物)的大量持久增加和17-羟孕酮(17-OHP)(21-羟化酶的底物)的减少为BBP-631转基因的持久活性提供了令人信服的证据:在最高剂量水平,持续的11-脱氧皮质醇与基线相比平均增加了55倍,与基线相比最大增加了99倍。这意味着平均最大值是正常值上限的23倍。17-羟孕酮大幅降低,大多数患者的降幅≥50%,最大降幅达95%。
· BBP-631 的耐受性良好,仅有轻度至中度的治疗突发不良事件 (TEAE),未报告与治疗相关的 SAE。
BridgeBio首席执行官兼创始人Neil Kumar博士说:“虽然迄今为止的数据还不能说明问题,但这项研究首次表明,CAH 患者确实可以自己制造皮质醇,而且基因疗法可以在这一患者群体中安全应用。我们将继续致力于为 CAH 群体寻找合适的合作伙伴,并对预筛选研究和 ADventure 研究的参与者和表示有兴趣的人表示感谢。我们还要感谢ADventure研究的调查人员和工作人员、CAH患者权益组织以及更广泛的CAH社区。"
BridgeBio首席财务官、特许金融分析师、博士Brian Stephenson表示:"鉴于试验结果未达到目前需要追加资本投资的门槛,BridgeBio将按照我们的资本分配原则,削减基因疗法预算超过5000万美元,并将基因疗法保留给我们无法以其他方式治疗的优先靶点。我们相信基因疗法有可能满足尚未得到满足的巨大需求,我们渴望与 FDA 和卡纳文社区密切合作,目标是尽快将我们的疗法带给卡纳文病患者家庭。”
BridgeBio将不再致力于开发BBP-631用于治疗CAH ,但公司仍在积极寻求合作机会,以支持 BBP-631或用于治疗CAH 的下一代基因疗法的未来开发。该公司2个产品已处于商业化阶段,目前有8条研发管线,包括Acoramidis在内的3个候选产品处于3期临床试验阶段。

BridgeBio公司目前的主要工作是为其转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)药物acoramidis可能获得批准做准备,美国FDA将于11月29日对该药物做出决定。Acoramidis是一种口服、强效、高选择性小分子转甲状腺素蛋白(TTR)稳定剂,用于治疗ATTR-CM。BridgeBio已授予拜耳(Bayer)公司在欧洲商业化acoramidis用于治疗ATTR-CM的独家权利。
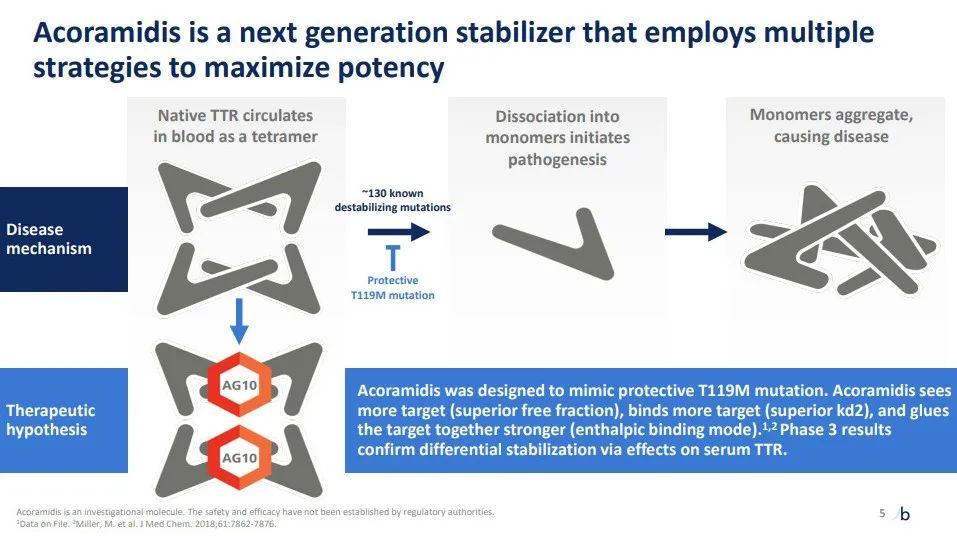
Acoramidis作用机制(图片来源:公司官网)
公司管线中还有一款用于治疗卡纳万病的在研静脉注射(IV)AAV9基因疗法BBP-812。2024年9月10日,BridgeBio Pharma宣布美国FDA已授予BBP-812再生医学高级疗法(RMAT)称号,RMAT指定是在美国FDA对研究BBP-812的CANaspire 1/2期临床试验的临床数据进行审查后授予的,BBP-812是一种潜在的疗法,可满足卡纳万病患者尚未得到满足的医疗需求。
据联邦试验数据库显示,BridgeBio的子公司Aspa Therapeutics正在一项1/2期开放标签研究中测试这种代号为BBP-812的疗法,该研究将于2026年10月结束。

图片来源:https://clinicaltrials.gov
此外,BridgeBio正与National Resilience合作,生产候选药物及其管线中的其他基因疗法。BridgeBio公司也表示目前正在 “积极寻求合作机会”,以开发基因疗法或治疗遗传病的潜在后续候选药物。该公司称,CAH影响着美国和欧盟约75,000人。
参考资料:公司公告
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论