
8月1日,Adaptimune Therapeutics公司宣布,美国FDA批准其在研工程化T细胞疗法Tecelra(afami-cel)用于二线治疗既往接受过化疗治疗的不可切除或转移性滑膜肉瘤成人患者,这些患者的肿瘤表达黑色素瘤协同抗原4(MAGEA4),且HLA-A*02:01P阳性、HLA-A*02:02P阳性、HLA-A*02:03P阳性、HLA-A*02:06P阳性。afami-cel为首款用于治疗实体瘤的工程化T细胞疗法,也是十多年来治疗滑膜肉瘤的首个有效疗法。


Afami-cel是一种针对MAGE-A4癌症靶点的工程化T细胞受体(TCR)T细胞疗法,被设计作为一种用于晚期滑膜肉瘤的一次性疗法。
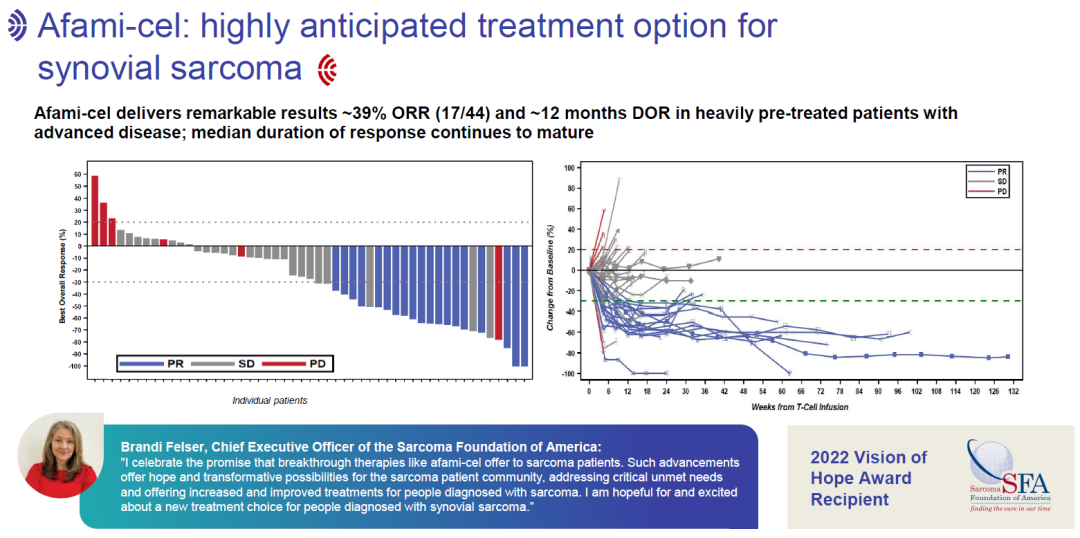
此次批准主要是基于一项关键性研究SPEARHEAD-1中队列1的积极数据。该试验包括44名患者,研究的主要终点是总体缓解率(ORR)。
结果显示,中位随访32.6个月时,滑膜肉瘤患者的ORR达到了39%(17/44),中位缓解持续时间(DOR)为11.6个月,中位总生存期(OS)尚未达到,中位无进展生存期(PFS)为3.8个月。
TECELRA的常见不良反应包括细胞因子释放综合征(CRS)、恶心、呕吐、疲劳等。此外,该疗法还可能会引发细胞减少症、感染、二次恶性肿瘤及过敏反应等严重副作用。TECELRA不适用于HLA-A*02:05P纯合子或杂合子成人患者。
继Afami-cel获批之后,Adaptimmune计划在2026年推出用于滑膜肉瘤和黏液样圆细胞脂肪肉瘤(MRCLS)的lete-cel,这是一款靶向NY-ESO-1的TCR-T细胞疗法,目前处于2期临床试验阶段。此前,lete-cel的一项临床研究数据显示,73例接受Lete-cel治疗的患者中有45例可评价,其中ORR达到40%,2例CR,16例PR。值得一提的是,据预测,Afami-cel和lete-cel的峰值销售额将可能达到4亿美元。
参考资料:公司官网
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论