
前不久的2024年美国糖尿病协会科学年会(ADA)上,恒瑞医药披露了其自主研发的GLP-1/GIP双受体激动剂HRS9531最新Ⅱ期研究结果,HRS9531显著降低肥胖患者的体重,并改善腰围、血压、甘油三酯、血糖和胰岛素抵抗等代谢指标,耐受性良好,这为其将来在超重或肥胖人群中进一步研发奠定了坚实的基础。
千亿降糖/减重市场,恒瑞已经下重注
2023年11月16日,恒瑞医药2023研发日活动在上海浦东成功举办。会上数据显示,慢病管理方面,恒瑞共有接近60款创新产品在研。在降糖/减重领域,GLP-1R/GIPR双激动剂HRS9531、口服GLP-1小分子HRS-7535在会上进行了重点介绍,体现了恒瑞医药对于这一千亿市场的重视。

狂飙的”GLP-1R”,恒瑞已有5款新药进入临床
在医药「寒冬」的冷风呼啸之中,GLP-1R正逆流直上,呈现炙手可热之姿。在包括肥胖在内的全代谢谱系适应症布局加持之下,这类药物已经火出医药圈外。行业内的人直呼:完蛋!我被GLP-1包围了。
截止目前,诺和诺德和礼来处于全球GLP-1R药物研发第一梯队,不仅手握重磅上市药物(利拉鲁肽、度拉糖肽、司美格鲁肽、替尔泊肽),其余多条管线已进入临床Ⅱ/Ⅲ期,不久后将迎来收获期。
中国已成为全球研发最卷的地区之一,研发布局以GLP-1R单靶点布局为主,部分在该领域布局深厚的公司开展双靶点/三靶点新药的临床研究。国内目前,恒瑞医药、信达生物、华东医药……处于国产GLP-1R新药研发的相对领先的位置。其中恒瑞医药已有5款GLP-1R相关新药进入临床研究,两款双靶点药物引人注目:GIPR/GLP-1R双靶点激动剂HRS9531、GCGR/GLP-1R双靶点激动剂SHR-1816。

管线1:GIPR/GLP-1R双靶新药HRS-9531
HRS9531是一款靶向GIPR/GLP-1R的在研新药。GLP-1和GIP是两种天然的肠促胰素,研究表明GIP可以减少食物摄入、增加能量消耗,从而减轻体重。当GIP与GLP-1受体激动剂联合使用时,可能会对患者血糖和体重产生更大的影响。2023年5月5日,CDE官网显示,恒瑞医药1类新药HRS9531注射液已获批临床,用于减重。目前,HRS9531肥胖3期和2型糖尿病的2期临床试验正在积极推进中。

来源:药融云中国临床试验数据库
在2024年美国糖尿病协会科学(ADA)年会上,恒瑞医药:首次披露了其自主研发的GLP-1/GIP双受体激动剂HRS9531最新II期研究结果,治疗24周后,HRS9531注射液1.0 mg、3.0 mg、4.5 mg和6.0 mg剂量组体重自基线分别下降5.4%、13.4%、14.0%、16.8%,而安慰剂组仅下降0.1%。
管线2:GLP-1R /胰岛素复方制剂HR-17031
HR17031是诺利糖肽与胰岛素的复方制剂,其糖尿病适应症目前正处于2期临床阶段。值得一提的是,目前临床阶段尚无国内企业开发同类药物。来自诺和诺德的 Xultophy(德谷胰岛素+利拉鲁肽)和赛诺菲的 Soliqua(利司那肽+甘精胰岛素)2 款进口药是国内获批仅有的同类药物,获批时间在 2021 和 2023 年。诺和诺德还开发了司美格鲁肽+长效胰岛素 Icodec 的复方制剂 IcoSema,国内已启动 III 期临床。GLP-1R + 胰岛素的组合,能够给糖尿病患者带来更有效的治疗,HR17031有望占据一定的市场。

来源:药融云中国临床试验数据库
2024年4月28日,药物临床试验登记与信息公示平台显示,恒瑞启动了HR17031注射液的一项随机、开放、平行对照、治疗达标III期临床试验(CTR20241529)。该研究旨在接受二甲双胍联合或不联合另一种口服降糖药治疗血糖控制不佳的2型糖尿病患者中,比较HR17031 注射液与甘精胰岛素的有效性和安全性,其主要终点为第26周时HbA1c相对基线的变化。
管线3:GLP-1R单靶新药诺利糖肽
诺利糖肽为恒瑞医药开发的利拉鲁肽的衍生物,一天注射一次,与目前已上市的GLP-1受体激动剂利拉鲁肽等相比,诺利糖肽不良反应发生率低。根据药融云中国临床试验数据库显示,诺利糖肽已经完成了肥胖和2型糖尿病的2期临床,三期试验开展在即。目前,单靶点的GLP-1药物非常难做出较司美格鲁肽优效,且国内有众多生物类似药/仿制药企虎视眈眈等待司美格鲁肽专利到期。恒瑞的诺利糖肽需要每日注射一次,虽然不良反应发生率较利拉鲁肽低,但与司美格鲁肽相比,劣势明显,市场空间可能有限。

2024年4月28日,药物临床试验登记与信息公示平台显示,恒瑞启动了HR17031注射液的一项随机、开放、平行对照、治疗达标III期临床试验(CTR20241529)。该研究旨在接受二甲双胍联合或不联合另一种口服降糖药治疗血糖控制不佳的2型糖尿病患者中,比较HR17031 注射液与甘精胰岛素的有效性和安全性,其主要终点为第26周时HbA1c相对基线的变化。
管线4:口服GLP-1R新药HRS-7535
HRS-7535是一种新型口服小分子GLP-1R药物。临床前研究发现,在无严格限食的情况下,HRS-7535可明显改善葡萄糖耐量,促进胰岛素分泌,减少摄食量。目前,不论是已上市还是正处临床阶段的GLP-1R药物,多是大分子蛋白,给药方式还是以皮下注射为主,导致患者依从性差。因此,更为方便的口服GLP-1R药物成为各大药企布局的对象。
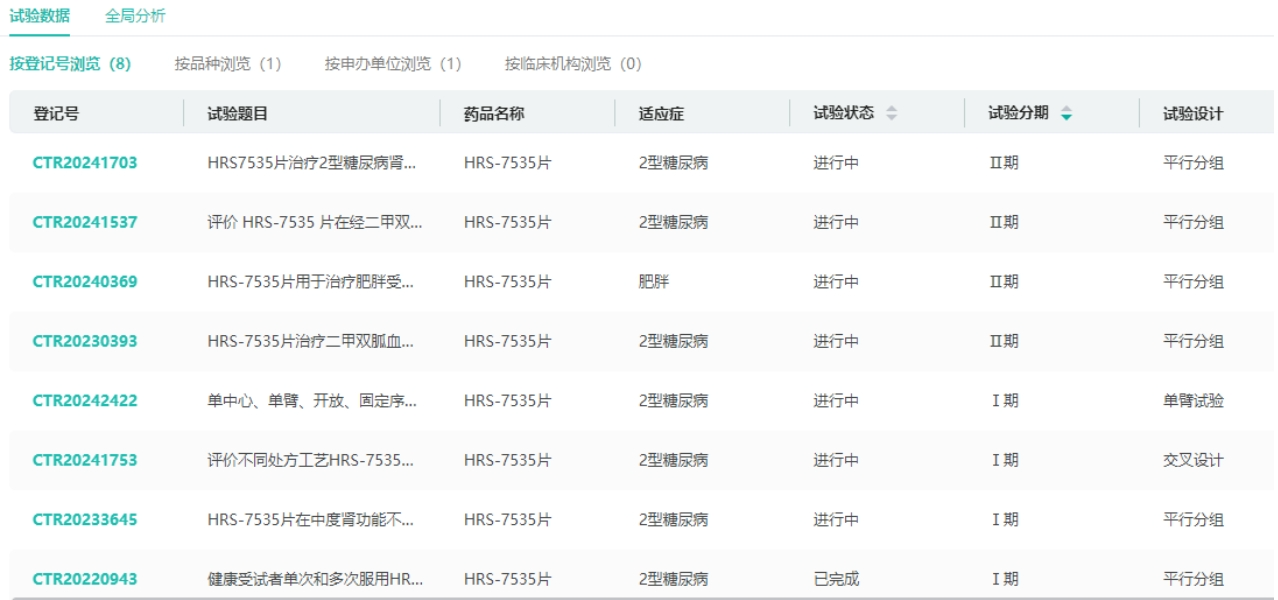
第83届美国糖尿病协会科学会议上,恒瑞公布了口服GLP-1R药物HRS-7535的I期临床研究数据(NCT05347758)。参与SAD和MAD的受试者各有24例。两组中治疗期间出现的不良事件(TEAE)均为轻度。PK大致成比例。在SAD中,HRS-7535给药范围内的中位达峰时间(Tmax)为5.98~5.99h,末端清除半衰期(t1/2)为5.28~9.08h。在MAD中,第28天时HRS-7535给药范围内的中位Tmax为5.98~10.98h,几何平均t1/2为6.48~8.42h。在MAD中,使用HRS-7535的受试者第29天时的体重自基线平均下降4.38 kg。无论SAD还是MAD,HRS-7535均具有可接受的安全性和良好的PK/PD;此外,在健康受试者中还可观察到体重明显下降。这些发现支持HRS-7535在代谢综合征患者中的进一步临床探索。
管线5:GCGR/GLP-1R双靶新药SHR-1816
恒瑞医药双靶GCGR抗体/GLP-1融合蛋白SHR-1816注射液在2022年3月获得临床批准,用于治疗成人Ⅰ型和Ⅱ型糖尿病,目前国内外尚无同靶点药物上市,该项目累计研发投入超过4359万元。目前SHR-1816已经开展了1期临床,主要研究目的:在健康受试者中评价SHR-1816皮下注射单次给药剂量递增和多次给药的安全性和耐受性。次要研究目的:在健康受试者中评价SHR-1816皮下注射单次给药剂量递增和多次给药的药代动力学(PK)、药效学(PD)特征和免疫原性。
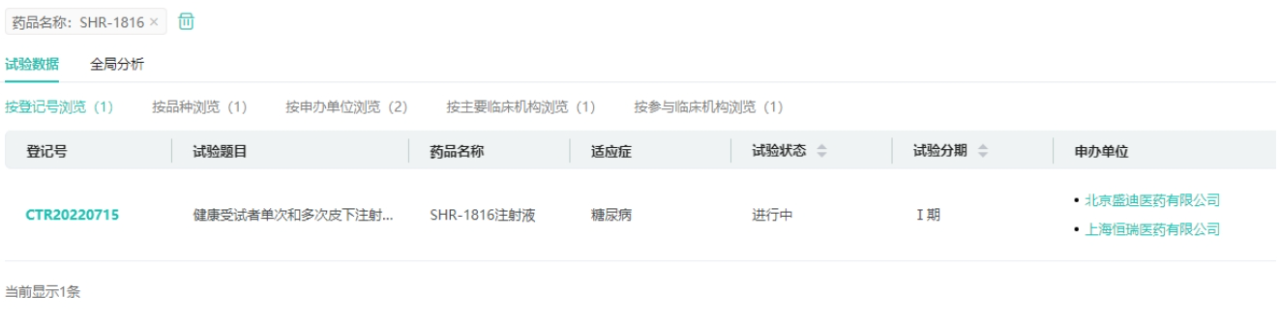
研究证实,GCGR/GLP-1R双重激动剂能激活GLP-1R提高胰岛素分泌并且降低食物摄入,并通过激活GCGR起到降低炎症和脂肪生成。目前,针对这两个靶点,多个药企已布局治疗糖尿病、肥胖的药物。
在全球范围,Mazdutide(玛仕度肽、IBI362)处于GLP-1R/GCGR研发的第一梯队。玛仕度肽(研发代号:IBI362)是信达生物与礼来(Eli Lilly and Company)共同推进的一款GLP-1R/GCGR双重激动剂。该产品已在多项临床研究中展现出良好的减重和降糖疗效,以及降低腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量,以及改善胰岛素敏感性,带来多重代谢获益。2024年2月7日,国家药品监督管理局药品审评中心(CDE)官网显示,信达生物提交的玛仕度肽上市申请获受理,用于成人肥胖或超重患者的长期体重控制。此前,玛仕度肽在中国超重或肥胖受试者中的III期临床研究GLORY-1(NCT05607680)已于2024年1月达成主要研究终点和所有关键次要终点,玛仕度肽4mg组和6mg组受试者体重和多项心血管代谢指标的改善均显著优于安慰剂组。
在2024年美国糖尿病协会科学(ADA)年会上,信达生物:玛仕度肽的减重III期GLORY-1研究结果显示,治疗32周后,相比安慰剂组,玛仕度肽4 mg、6 mg剂量组分别减重10.72%、13.14%。且玛仕度肽9 mg高剂量II期临床的最新数据显示,治疗24周后实现减重15.4%。
总结
利拉鲁肽、度拉糖肽、司美格鲁肽、替尔泊肽四款产品的商业化成功点燃了GLP-1R赛道的研发热情。目前,诺和诺德和礼来占据了近90%GLP-1R的市场份额,先发优势、产能优势和管线厚度等Buff叠加,使得后续入场的药企压力巨大。如果后续不能在药效、服药周期等指标上展现出优势,而价格又不能与仿制药比拼,基本将陷入还未入局就将出局的窘境。作为国产新药研发“一哥”的恒瑞,重仓了GLP-1R赛道,期待其多款GLP-1R药物未来的表现。
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论