
FDA于1992年为了应对艾滋病危机创建了加速批准途径(AA),随后将其用于癌症治疗中,欧盟则于2006年建立了有条件上市许可(CMA),类似于FDA的加速批准。
中国自2015年起启动了有条件批准(CA)项目试点,这意味着新药可以在替代终点或中间临床终点的基础上更早获得批准,类似于FDA的AA和EMA的CMA项目。

图1:中国药品监督管理局有条件批准的时间表
FDA要求AA药物在指定的时间范围内完成验证性临床试验,以确定是转换为常规批准还是退出市场,但近一半获得AA药物没有显示出临床益处,且AA目前似乎成为了一些药物的“免死金牌”。由于上市后研究的设计局限性和/或其不及时完成,这种不确定性可能会在初始批准后持续数年。

图2:2013年至2023年肿瘤药物加速获批监管结果
FDA的AA饱受争议:尽管药品已经达到了方案规定的主要终点(大部分为替代终点),但药物的临床益处仍然值得怀疑。如上所述,AA成为药物的“免死金牌”,适应症在药物标签和临床实践指南中保留了数年才被撤销。
随着CA在癌症领域的应用逐渐增加,中国也可能面临这些挑战。2015年至2022年期间获得NMPA授予CA的56种新抗癌药物,总计72个适应症。其中,38种(53%)癌症适应症仅在中国获得批准,32个(44%)和30个(42%)癌症适应症也分别获得了FDA和EMA的批准。
在FDA批准的适应症中(32个),59%(19/32)和41%(13/32)分别获得了AA和常规批准。EMA批准了30种癌症适应症,分别有40%(12/30)和60%(18/30)获得了CMA和常规批准。CMA的药物比例低于FDA(40%对59%),这可能部分是由于EMA只授予CMA的初始适应症,而FDA和NMPA允许AA和CA药物的初始和补充适应症。

图3:2018年至2022年在中国有条件批准癌症适应症
这些关键性临床试验主要是单臂试验设计(72%)。在72项关键临床试验中,RR是主要终点(75%),其次是PFS(10%)、OS(6%)和OS联合PFS(4%)。
表1:2015-2022年获得NMPA的CA抗癌药物(终点设计)

在临床试验设计方面,采用单臂试验的国产抗癌药物比例显著高于进口抗癌药物(68% vs. 32%)
表2:2015-2022年获得NMPA的CA抗癌药物(试验设计)

药品获得CA之前应该启动抗癌药物的验证性临床试验,此外,NMPA还规定了完成CA癌症药物验证性临床试验的严格时间表。随着越来越多的CA癌症药物获批上市,NMPA应进一步明确验证性临床试验证据的要求,包括尽可能使用临床终点和RCT设计。
与美国AA相比,中国仍处于CA计划实施的初步阶段,由于缺乏可用数据,这些CA肿瘤药物是否在验证性临床试验中转化为临床益处尚未可知。为了确保这些抗癌药物在没有临床益处的情况下可以在第一时间撤回或撤销市场,追踪FDA加速撤销药品的监管状况可能为我们带来一些启发。
大多数获得FDA的AA途径并随后在美国撤回的癌症药物适应症都有负面的验证性临床试验结果,其余的则是不完整的验证性临床试验或因安全问题而停止的试验。所有这些阴性验证性临床试验都被设计为随机对照试验,并将总生存期作为主要或次要疗效终点。
截止到去年10月底,FDA有187个癌症适应症获得AA,其中65个正在进行验证,96个转为传统批准,26个适应症自该计划启动以来已被撤回AA。26个癌症适应症中有21个(81%)基于单臂研究设计;适应症中有17个(65%)归因于阴性的验证性临床试验结果,7个(27%)归因于未能完成验证性临床试验,2个(8%)归因于安全性问题。从加速批准到最终停药的中位持续时间为4.1年(IQR为2.7 - 7.5)。
已撤销的26个癌症适应症中,5个(19%)在中国已获批,8个(31%)处于新药研究阶段,3个(12%)已自愿终止新药研究阶段,1个(4%)已自愿撤销新药申请阶段,9个(35%)尚未在中国报批(无新药或新药申请信息)。
表3:FDA已撤销的癌症适应症的监管状况以及目前在中国的监管状况
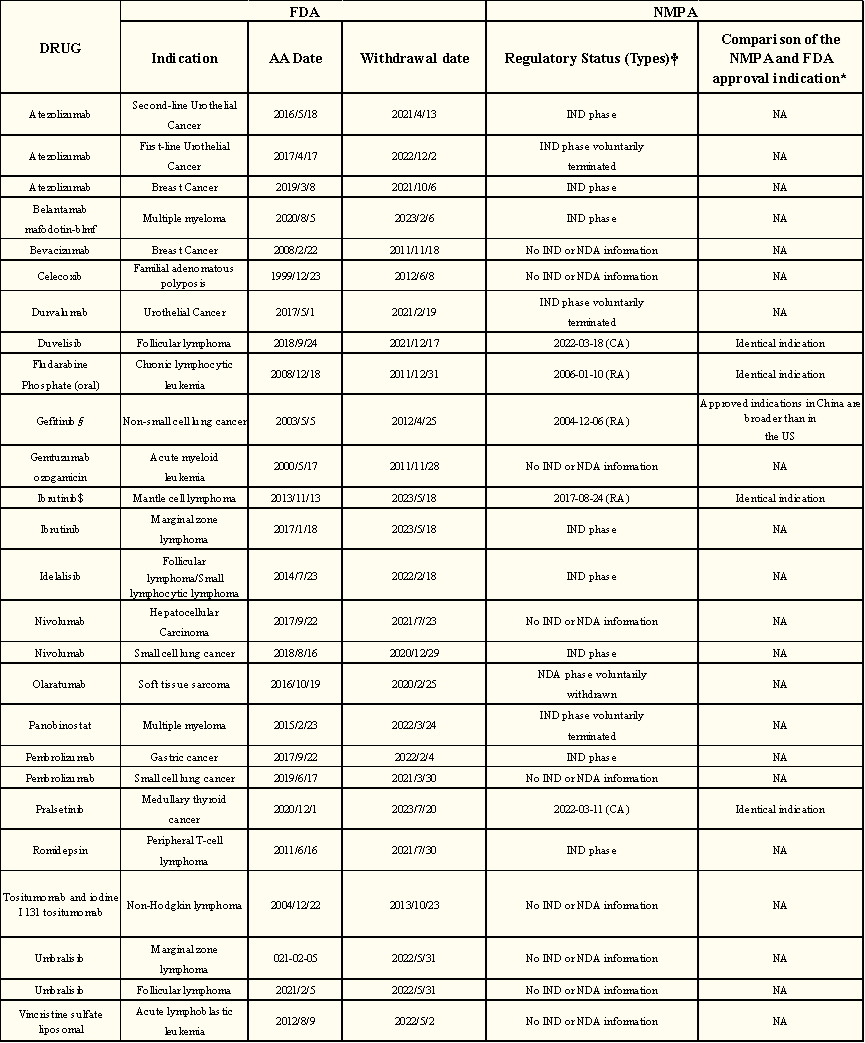
图4:FDA已撤销癌症适应症监管状态时间表
目前,5个在中国已获批的适应症中,只有一个适应症在获得FDA加速批准前在中国获得批准,其他四个适应症在获得FDA加速批准后在中国获得批准。5个癌症适应症中,有2个获得了CA,3个适应症获得了常规批准(当时没有建立有条件的批准程序)。其中,4个(80%)的批准时间晚于美国。
在72种获得NMPA的CA批准癌症中,有41种适应症由国内制造商生产,31种由进口适应症生产。31个进口适应症中,30个获得FDA批准,28个获得EMA批准,这表明FDA和EMA在大多数癌症药物的获益风险评估中是一致的。
那么,美国撤销癌症适应症的加速批准:欧盟的上市许可状况又如何?
截止去年4月,FDA批准23种癌症适应症(18种不同的药物)加速审批,而后被撤销,其中13个(57%)向EMA提出了类似的上市许可申请。
在这13个适应症中,3个(23%)被拒绝上市许可,1个(8%)获得了有条件上市许可,但后来被撤回,其余9个(69%)在欧盟获得了类似适应症的上市许可(8个标准上市许可和1个有条件上市许可)。
中国撤销加速审批适应症的数量低于欧盟国家确定的数量。这种差异可能是因为在中国批准新型癌症药物的提交延迟比在欧洲更长,因为从美国撤回的大多数加速批准适应症在中国仍处于新药研究或新药申请阶段,或者尚未计划在中国上市。
表4:FDA批准的癌症适应症撤销加速批准与EMA批准的相关适应症的比较

以Duvelisib为例看下它在美国加速审批/撤回和欧盟上市许可的批准情况:
Duvelisib作为滤泡性淋巴瘤的三线治疗药物于2018年9月获得FDA的加速批准。为了继续获得批准,FDA要求进行一项随机3期研究,以无进展生存期为主要终点(提交验证性研究报告的截止日期为2020年11月)。2021年5月,Duvelisib基于与加速批准适应症相同的证据,获得了EMA的标准上市许可。该批准基于一项单臂2期研究,客观缓解率为主要终点。

图5:在美国加速审批/撤回和欧盟上市许可的批准时间表(以Duvelisib为例)
1992年至2023年4月在美国撤销的23个加速批准的癌症适应症中,有9个在欧盟获得了类似适应症的上市许可。相比之下,2006年2023年4月20日期间,欧盟仅撤销了两项针对癌症适应症的有条件上市许可,这两种药物在美国都不再被批准。
与FDA相比,EMA更常接受单臂研究以确认临床益处,而FDA更常要求随机对照试验。两家机构主要依靠患者利益的替代措施来履行上市后义务。在中位随访7年后,AA 和 CMA 后分别有 40% 的 FDA 和 61% 的 EMA 上市后义务被推迟(初始批准时提交的证据的初步性和有限性带来了不确定性,这可以通过强制性的上市后研究来解决)。
这些数据显示了FDA、EMA和NMPA批准决定之间的差异。
机构的AA/CMA/CA途径中适应症的收益-风险平衡可能接近相等,导致不同的药物命运;上市后研究可能无法充分解决收益-风险比不确定性的另一个原因是使用了替代指标,如PFS(广泛使用的替代物PFS在癌症中的有效性也往往仍未得到证实),而不是与患者相关的结果,例如总生存期或生活质量;
而且在AA/CMA/CA途径中申请的时间之间可能存在差异,这种延迟可能会导致一些在美国完成验证性临床试验后获得AA的癌症适应症被撤回市场,而这些适应症仍在中欧验证性临床试验中。
实际上,在中国不仅仅是获得FDA的AA途径肿瘤药物,大部分肿瘤药物NMPA在审查时间慢于FDA。
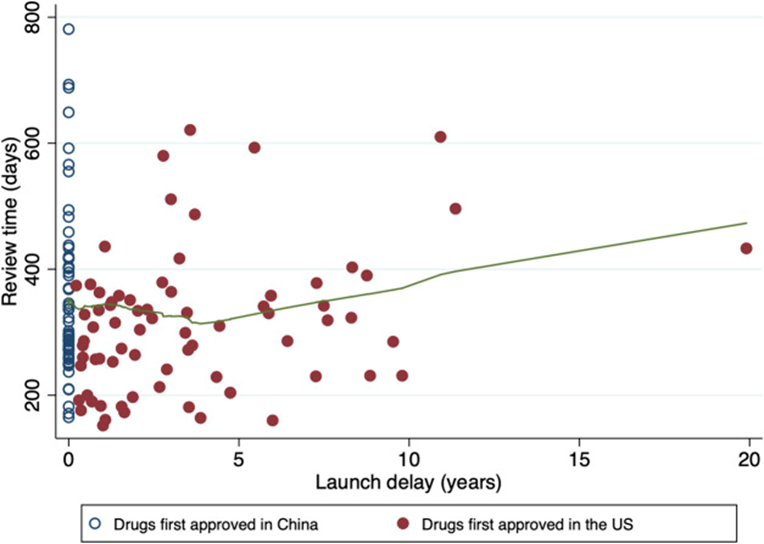
图6:药物审查时间
加强各机构之间的合作和数据共享将有助于减少审批差异,特别是对于通过AA途径销售的癌症药物。药品主管部门需要做出更多努力,以更好地在减少不确定性和促进有前途的新药供应之间取得平衡。
参考材料:
1. Luo X. Evidence of pre-approval clinical trial supporting the granted conditional approval for novel cancer drugs in China between 2015 and 2022. EClinicalMedicine. 2023
2. Luo X. Current regulatory status in China of drugs withdrawn from the US FDA accelerated pathway: implications for regulation globally. Lancet Oncol. 2024
3. Cramer A. Withdrawn accelerated approvals for cancer indications in the USA: what is the marketing authorisation status in the EU? Lancet Oncol. 2023
4. Zhu X. Review time of oncology drugs and its underlying factors: an exploration in China. Front Pharmacol. 2023
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论