
6月7日,据CDE官网站显示,百济神州HER2双抗泽尼达妥单抗(zanidatamab)上市申请获得受理。2023年11月,该产品被纳入优先审评,适应症为治疗既往接受过全身治疗的HER2高表达的不可切除局部晚期或转移性胆道癌患者。

截图来源:CDE
泽尼达妥单抗为一款HER2双表位双抗,由Zymeworks研发,百济神州于2018年引进日本、印度外的亚太地区权益。泽尼达妥单抗相较于曲妥珠单抗,其在不同HER2过表达的肿瘤细胞类型及表达水平下,均展现出更为显著的体外与体内抗肿瘤活性。通过人类细胞系和动物模型的研究,进一步揭示了泽尼达妥单抗对HER2低表达肿瘤亦具备潜在的临床治疗效果。
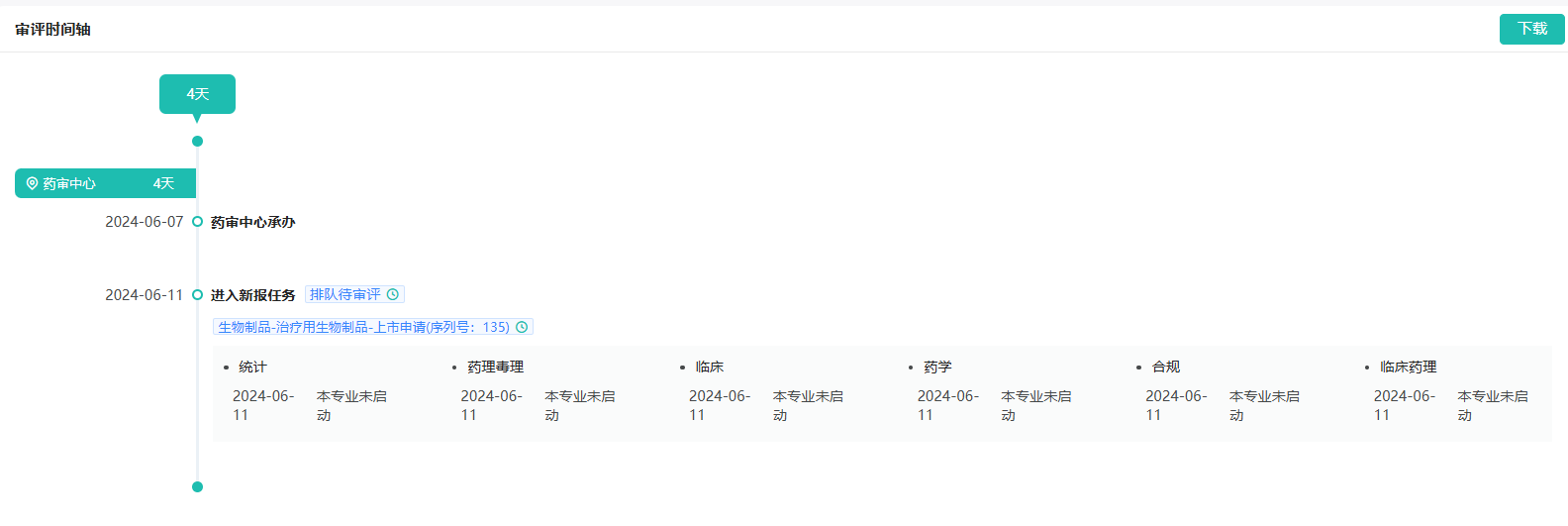
截图来源:药融云中国药品审评数据库
2023年6月,百济神州在ASCO大会上发布了HERIZON-BTC-01研究的IIb期结果。这是一项全球性的开放标签研究,共招募了87名曾接受吉西他滨治疗的HER2扩增局部晚期不可切除或转移性胆道癌患者。研究的主要目标为通过独立中心审查(ICR)确认的HER2阳性队列的客观缓解率(cORR),同时亦关注其他疗效和安全性数据。
结果显示,在HER2阳性患者中,cORR高达41%,中位反应持续时间(DOR)长达12.9个月。中位研究随访时间为12.4个月,截至2022年10月10日,在33名应答者中,49%的患者持续应答,82%的患者DOR达到或超过16周,首次应答的中位时间为1.8个月。
安全性方面,72%的患者出现了治疗相关不良事件(TRAE),其中腹泻(37%)和输液相关反应(33%)为主要不良反应,且≥10%的患者受此影响。18%的患者发生了3级TRAEs,而2名患者因不良事件而停用泽尼达妥单抗,7名患者遭遇严重TRAE。
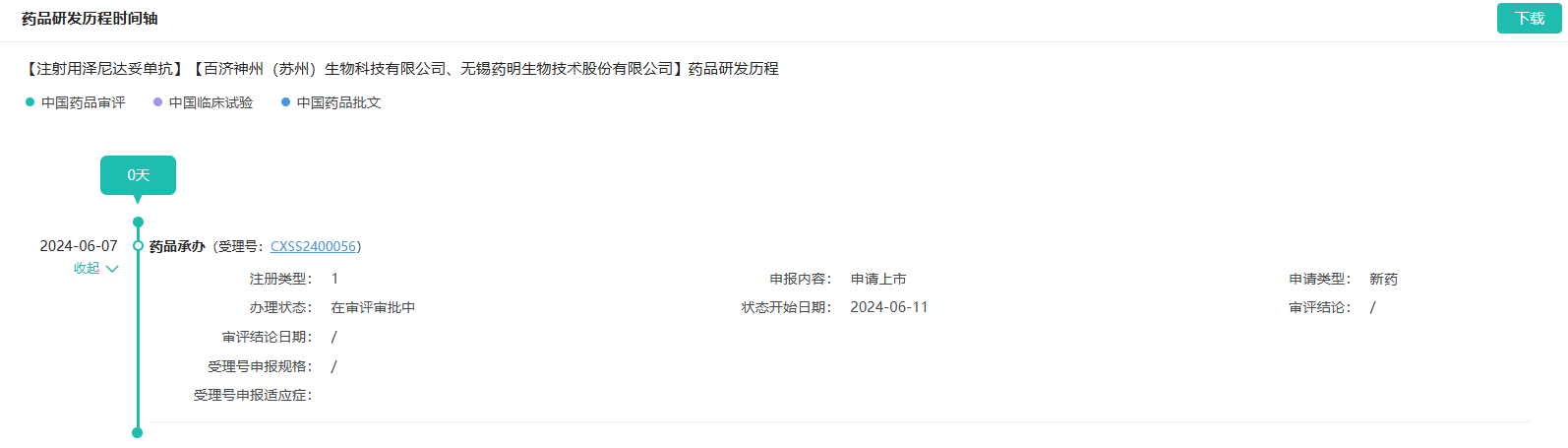
截图来源:药融云中国药品审评数据库
值得一提的是,今年ASCO大会上首次公布的长期随访数据显示,接受zanidatamab治疗的患者中位总生存期(OS)达到了15.5个月。目前,FDA已受理zanidatamab的生物制品许可申请(BLA),并给予其优先审评资格,PDUFA日期定为2024年11月29日。
参考来源:
[1] CDE官网
[2] 药融云数据库
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论