
药融云数据库显示:近期,D3 Bio(德昇济医药)获得6200万美元A+轮融资(约合4.5亿人民币),领头投资方为欧洲著名风险投资公司Medicxi,老股东经纬创投和药明康德风险投资(WuXi AppTec's Corporate Venture Fund)继续跟投。目前产品线涵盖小分子以及抗体/双抗领域。(注:Medicxi的经典投资案例包括Versanis Bio,礼来制药收购了该公司,旨在获得激活素受体II型拮抗剂的Bimagrumab)相关阅读:2亿美元!德昇济医药产品线披露,涵盖小分子、抗体领域
最快的资产D3S-001 是德昇济医药研发的一款第2代选择性共价 KRAS G12C 小分子抑制剂,旨在增强 KRAS G12C 靶点结合。在临床前研究中,D3S-001 表现出高效力、中枢神经系统渗透特性以及在预测的临床相关剂量下实现完全 KRAS G12C 靶点参与的能力。目前该药物正处于全球1/2期临床试验开发阶段。

2024年美国AACR 年会上德昇济医药首次公布了 D3S-001 的1期(NCT05410145)人体临床试验数据。另外还有一篇摘要发布。
D3S-001 单药用药方案以 6 个计划剂量水平(每日 50-900 毫克)对来自 3 个国家的 KRAS G12C 突变晚期实体瘤患者进行治疗。截至 2024 年 2 月 6 日,共有 41 名患者接受了给药,分别是25 名非小细胞肺癌、12 名结直肠癌和 4 名胰腺癌受试者。
中位随访时间为 5.1 个月(m,范围 0.2-15.4m),28 名患者 (68.3%) 仍在研究治疗中,没有观察到与治疗相关的剂量限制性毒性 DLT 或死亡。30 名患者 (73.2%) 发生各种级别的治疗相关不良反应 AE (TRAE)。其中,3 级 6 人(14.6%)(无 4 级及以上)。11 名患者 (26.8%) 因 TRAE 修改了 D3S-001 剂量,没有患者因 TRAE 停药。
在 37 名进行基线后肿瘤评估的患者中,33 名未接受过 G12Ci,4 名接受过 G12Ci 预处理。在 33 名未接受过 G12Ci 治疗的患者中,总体人群中 25/33 例(75.8%,95% CI 57.7, 88.9%)实现部分缓解(PR),14/20 非小细胞肺癌(NSCLC)患者(70.0%,95% CI 45.7, 87.2%)实现部分缓解(PR),7/ 9 名结直肠癌(CRC)患者(77.8%,95% CI 40.2,96.1%),以及 4/4 名胰腺癌(PDAC)患者(100.0%,95% CI 39.6,100.0%)。在 2/6 的 NSCLC 患者中观察到中枢神经系统渗透(CNS)功效。在所有 G12Ci 初治患者 (n=36) 中,6 个月无进展生存期(PFS)率为 69.1% (95% CI 46.3, 83.7%),但中位 PFS 和 DoR 尚未成熟。
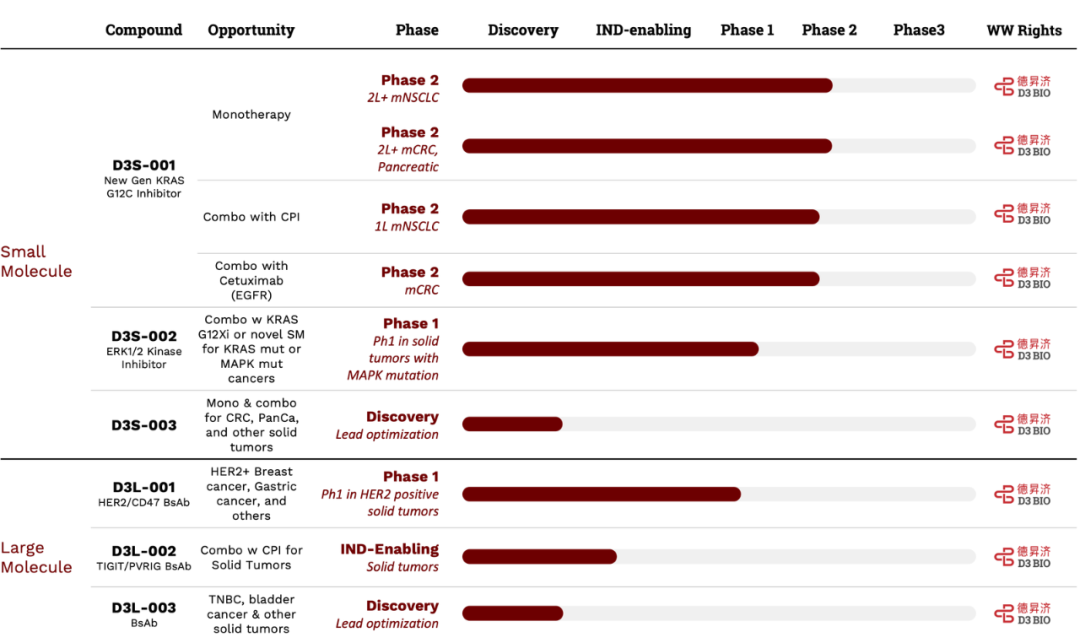
公司在研究的其他候选分子有:D3S-002,一种独特设计的新型小分子ERK1/2激酶抑制剂;D3L-001,HER2/CD47双特异性抗体;D3L-001为一款TIGIT/PVRIG双特异性抗体。

D3 Bio此前在2020年获得2亿美元的A轮融资,投资人包括博裕资本、淡马锡、经纬中国、红杉资本、药明康德、药明生物等。

此前A轮融资公告显示:药明系资金包括(药明基金一期、Hodge Lake(赵宁女士控制)、Bright Angel(李革博士控制)和药明人民币基金)合计持有29.65%股权,博裕资本旗下ASL持有15.88%股权,淡马锡旗下Elbrus Investments持有15.88%股权,红杉资本中国基金持有9.53%,经纬中国持有3.18%,创始人陈之键博士持有10%,创始人金奋宇博士持有7.98%,其他股东持有7.94%。

联合创始人陈之键博士是肿瘤药物开发领域的资深专家;曾主导多个重磅药物在中美两地的注册申请和市场推广,共完成70多项新药临床试验申请(IND)和30多项新药申请 (NDA) 批准。联合创始人金奋宇博士在生物科技风险投资、公司业务发展、政府事务以及中国及国际范围内有关癌症及其他药物的全球跨境授权交易方面有丰富经验。
参考:
NMPA/CDE;
药融云数据www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;等等
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论