
据药融云数据监测显示:2024年2月25日,来自韩国的生物制药初创企业AriBio Co., Ltd.(AriBio)收到英国药品和保健品监管局 (MHRA)签发的早期阿尔茨海默症3期临床试验POLARIS-AD的受理通知。MHRA于2月21日完成审查并确认了有利的意见,公司预计于2024年第一季度末之前在英国启动该项临床试验。
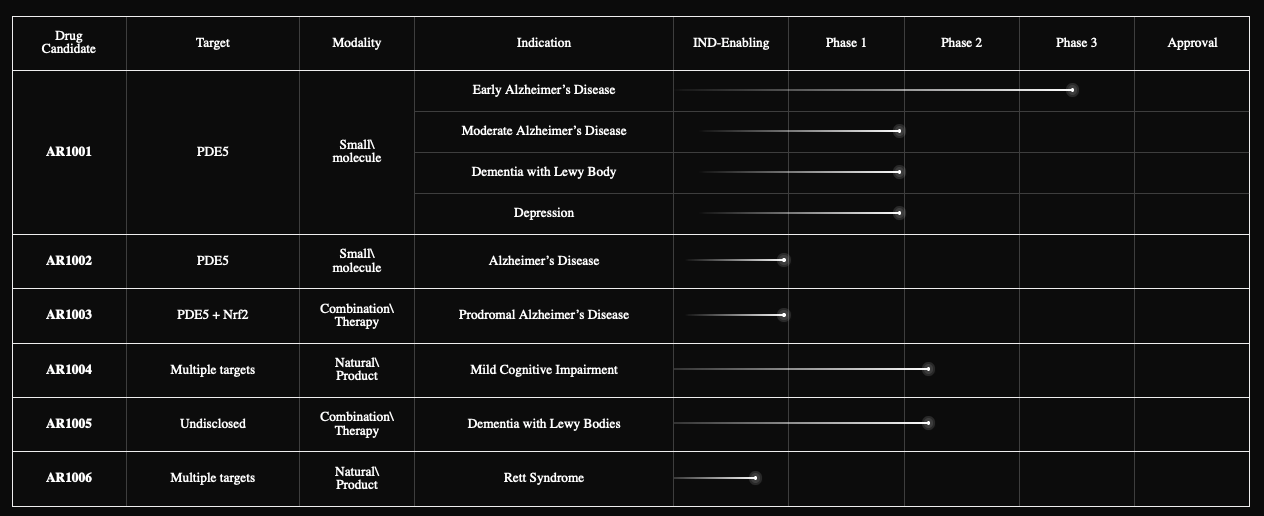
Pipeline of AriBio

截图来源:药融云新闻资讯数据库
POLARIS-AD是一项双盲、随机、安慰剂对照、多中心注册试验,旨在评估AR1001(Mirodenafil,音译米罗地那非)治疗早期阿尔茨海默病患者52周的疗效和安全性。该试验使用美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)认可的主要终点:临床痴呆评分 – 分数框总和(CDR-SB)以及次要终点:包括阿尔茨海默病评分 – 认知子评分13 (ADAS-Cog 13)、阿姆斯特丹日常生活工具活动问卷(A-iADL)、老年抑郁评分(GDS)、简易精神状态检查(MMSE),以及脑脊液(CSF)的变化和血浆生物标志物。所有早期阿尔茨海默氏病参与者均已入组,并将确认淀粉样蛋白。
AriBio首席临床官James Rock表示:“英国接受POLARIS-AD临床研究是AR1001研发的又一成果。本次接受表明第三个地区将在2024年第一季度积极筛选并招募参与者。如前所述,AriBio会继续将该研究扩展到监管和商业市场支持新型阿尔茨海默病治疗方法的其他地区。”
关于AR1001
AR1001是一种正在开发的磷酸二酯酶 5(PDE5)抑制剂,是一种治疗阿尔茨海默病的研究性口服药物。临床前研究已证实AR1001通过抑制神经元凋亡和恢复突触可塑性,从而具有神经保护作用,并显示出可能缓解AD病程的多种作用机制。

截图来源:药融云全球药物研发数据库
本品在中国已提交2项新药IND申请,目前正在审评中,注册分类为2.4类,改良新药,老药的新适应症探索。其中的CRO为Panacro (Hefei) Pharmaceutical Technology Co., Ltd.。原型分子最早由韩国SK开发。
关于AR1001-ADP3-US01
AR1001-ADP3-US01 (NCT05531526) 是3期双盲、随机、安慰剂对照、多中心试验,用于评估AR1001在52周内对早期阿尔茨海默病参与者的疗效和安全性。该研究旨在通过各种认知和功能评估来评估AR1001在减缓阿尔茨海默病进展方面的功效和安全性。临床试验的详细信息可参见ClinicalTrials.gov。
关于AriBio
AriBio Co., Ltd.是一家总部位于韩国,并且在美国设有办事处的生物制药公司。该公司专注于开发针对包括阿尔茨海默病在内的神经退行性疾病的新疗法。AI制药驱动的新药公司。

参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.aribio.com/;
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论