
近日,小核酸龙头Sarepta Therapeutics发布了2023年全年业绩:

2023年全年净产品收入共计11.45亿美元(约82亿元),同比增长36%,这一增长主要与对PMO疗法EXONDYS 51、AMONDYS 45 和 VYONDYS 53需求的增长,以及ELEVIDYS于 2023年6月获批后,与2023年销售相关的2.004亿美元的产品净收入有关;2023年总营收12.43亿美元,同比增长33%;研发费用8.77亿美元,与去年基本持平;其中2023 Q4产品净收入共计3.65亿美元,同比增长55%。

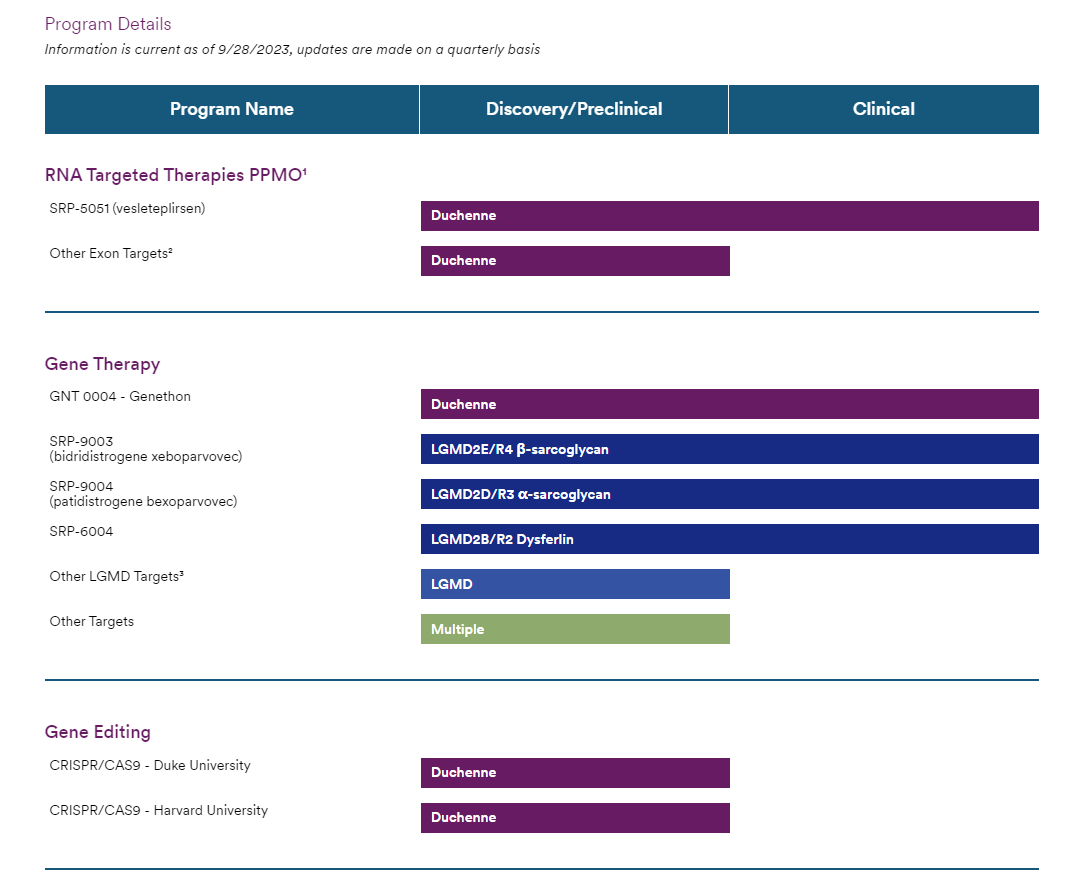
Sarepta已经开发并商业化了以下四款经批准用于治疗杜氏肌营养不良(DMD)的产品:Exondys 51(eteplirsen)、Vyondys 53(golodirsen)、Amondys 45(casimersen)和Elevidys,分别于2016年、2019年、2021年和2023年获FDA批准,分别用于外显子51、53和45跳跃的DMD患者和年龄在4-5岁之间患有DMD的非卧床儿童患者。
EXONDYS 51(eteplirsen)是Sarepta最早获FDA批准的用于治疗DMD的产品,也是FDA批准上市的第一款DMD治疗产品。2023年销售额5.4亿美元,同比增长6%;VYONDYS 53(golodirsen)2023年销售额1.3亿美元,同比增长11%;Amondys 45(casimersen)2023年销售额2.74亿美元,同比增长28%。
Elevidys是一款基于腺相关病毒(AAV)载体的基因疗法,通过基因工程办法将编码微抗肌萎缩蛋白的靶基因递送到骨骼和心肌肌肉组织,以弥补抗肌萎缩蛋白缺失。自2023年6月推出以来销售额超2亿美元,而Elevidys在第四季度销售额约为1.313亿美元,可见该药物需求强劲有望成为Sarepta的核心业绩动力引擎。

此外Sarepta宣布了美国食品和药物管理局(FDA)接受并提交了Sarepta公司对Elevidys生物制品许可申请(BLA)的疗效补充,并将其纳入了优先审评,PDUFA日期为2024年6月21日。Sarepta本次递交疗效补充申请有两个目标:一是将Elevidys适应症扩展为经证实DMD基因突变的杜氏肌营养不良患者;二是将Elevidys加速批准转化为常规批准。
该疗效补充申请基于两项研究结果的支持:EMBARK(SRP-9001-301研究)是一项针对4至7岁DMD患者的全球、随机、双盲、安慰剂对照3期临床研究;ENDEAVOR(SRP-9001-103研究)是一项针对DMD患者的开放标签临床研究,针对2岁及以上的患者。
除上述几款药物,SRP-5051与SRP-9003等产品也颇受关注,目前已进入临床阶段。Sarepta公布了新一代反义寡核苷酸疗SRP-5051治疗外显子51跳跃的DMD患者的2期研究MOMENTUM B部分的积极数据。数据显示,SRP-5051的目标剂量较高,约为30毫克/千克,每四周一次,治疗28周后,患者的肌营养不良蛋白平均表达率为5.17%,外显子平均跳跃率为11.11%(n=20)。在28周时,行动自如的参与者(4.76%,n=11)和非行动自如的参与者(5.67%,n=9)均出现了一致的肌营养不良蛋白表达。
此外,SRP-9003治疗肢带型肌营养不良2E型(LGMD2E/R4)患者的一项3期、多国、开放标签研究(SRP-9003-301 研究(又称 EMERGENE))正在招募中。
研发管线
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论