
1月16日,美国FDA 批准 Vertex Pharmaceuticals及其合作伙伴CRISPR Therapeutics的CRISPR/Cas9基因编辑疗法Exagamglogene autotemcel(Exa-cel,商品名:Casgevy) 用于治疗12岁及以上患者的输血依赖性β地中海贫血(TDT)。这是Casgevy获批的第2个适应症。
Casgevy药品基本信息

截图来源:药融云全球药物研发数据库
早在2023年12月8日,美国FDA批准Casgevy上市,用于治疗12岁及以上患有复发性血管闭塞危象的镰刀型细胞贫血病(SCD)患者,这是FDA批准的首款CRISPR基因编辑疗法。
2023年11月16日,Exagamglogene Autotemcel(Exa-cel)获英国药品监管机构MHRA有条件批准上市,用于治疗治疗SCD和TDT。
Casgevy原名CTX001™,是一种研究性、自体、体外CRISPR/Cas9基因编辑疗法,通过编辑患者自身的造血干细胞,使得患者血红细胞可以产生高水平的胎儿血红蛋白(HbF),以治疗输血依赖性β-地中海贫血和镰状细胞病。
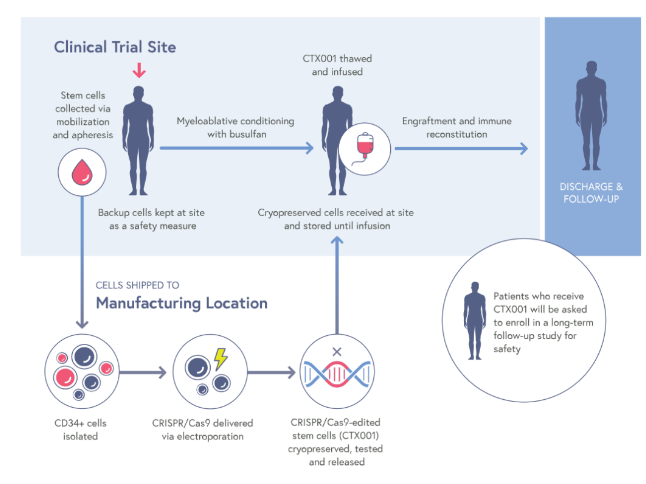
2015年,CRISPR和Vertex达成战略合作,专注于利用CRISPR/Cas9发现和开发针对人类疾病潜在遗传原因的潜在新治疗方法。Vertex负责exa-cel的全球开发、制造和商业化,并与CRISPR在全球范围内以60/40的比例分割项目成本和利润。
作为SCD的基因疗法,蓝鸟生物的Lyfgenia与Casgevy同一天获批,然而Casgevy更具优势:一是价格优势,Casgevy定价220万美元,Lyfgenia定价310万美元;二是接受Lyfgenia治疗的患者发生血癌而被黑框警告,Casgevy则没有。
作为TDT的基因疗法,虽然 Casgevy没有定价,但蓝鸟生物于2022年8月获FDA批准的 Zynteglo,定价为280万美元。
如果Casgevy作为TDT疗法的定价比蓝鸟生物的疗法要低,那么,无论是用于SCD还是TDT,Casgevy都更具竞争力。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论