
据美通社报道,1月2日,信达生物宣布:创新胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂玛仕度肽9mg (研发代号:IBI362) 在中国肥胖受试者中的一项III期临床研究(GLORY-2)完成首例受试者给药。
玛仕度肽药物基本信息

截图来源:药融云全球药物研发数据库
玛仕度肽是全球首个进入临床III期的GLP-1R/GCGR双靶激动剂,这是其开展的第四项大规模III期临床研究。
1.渊源深厚 来自礼来的宝藏
提到玛仕度肽(IBI362)就不得不说到GLP-1双巨头之一的礼来。
礼来的替尔泊肽作为全球首款获批上市的GIPR/GLP-1R双重激动剂,2023Q3销售额高达到14.09亿美元,凭借着强劲的疗效和良好的患者体验,上市以来放量速度超过司美格鲁肽和度拉糖肽。

而信达生物的玛仕度肽(IBI362)正是在2019年8月通过与礼来签订授权许可协议得来—— 这款临床阶段潜在全球同类最优糖尿病分子胃泌酸调节素类似物OXM3被信达寄予厚望。
这款GLP-1R/GCGR双靶激动剂除了通过激动GLP-1R促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动GCGR增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。
目前,玛仕度肽共有四项III期注册研究进行中,包括GLORY-1(4 mg和6 mg玛仕度肽治疗中国超重或肥胖受试者)、GLORY-2(9 mg玛仕度肽治疗中国肥胖受试者)、DREAMS-1和DREAMS-2(4 mg和6 mg玛仕度肽治疗2型糖尿病受试者)。
在市场进度方面,玛仕度肽的非酒精性脂肪肝炎(NASH)适应症已获得IND批件,用于治疗2型糖尿病的两项3期研究于2023年1月启动;而最受瞩目的肥胖适应症的首个NDA计划于2023年底至2024年初提交。
值得一提的是,礼来也在去年底重启了玛仕度肽用于减重的二期临床试验,足以证明信达生物的国内临床数据具有强大的潜力,能成为了礼来重启玛仕度肽的海外临床研究的重要参考依据之一。
2.头对头“神药”司美格鲁肽 信达生物的野心
回到本次临床试验本身,该研究计划入组约450例受试者,随机接受玛仕度肽9 mg或安慰剂治疗,主要终点是第60周时受试者体重相对基线的百分比变化以及体重相对基线下降≥5%的受试者比例。
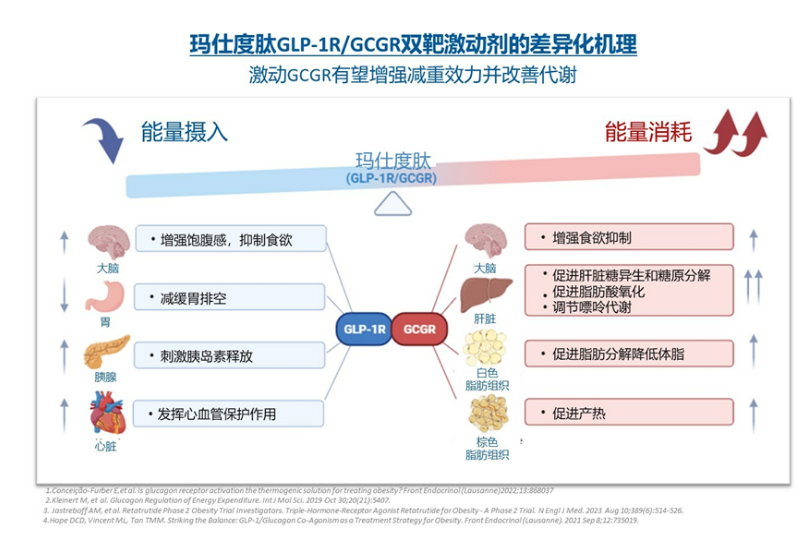
此前,在一项BMI≥30 kg/m2的中国肥胖受试者中开展的II期研究(NCT04904913)中显示,在给药48周后,玛仕度肽9 mg组体重降幅相较安慰剂组的差值−18.6%;玛仕度肽还显著降低受试者腰围、血脂、血压、血尿酸、转氨酶和肝脏脂肪含量等;耐受性和安全性良好,安全性特征与其他GLP-1受体激动剂类药物相似。
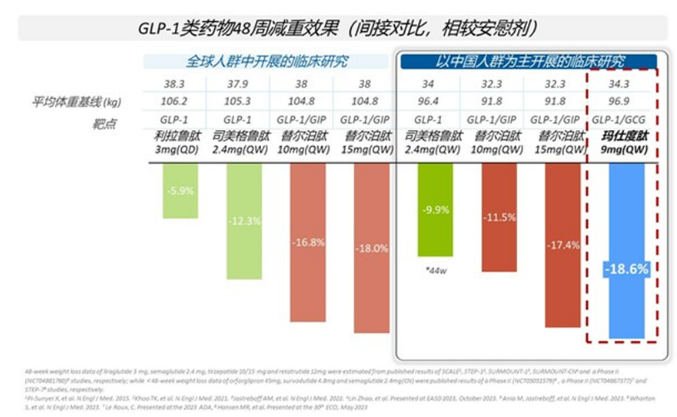
值得注意的是,本次选择的9mg剂量显然是为中国市场而量身打造。
因为在相似的BMI水平下,中国居民体脂率、心血管危险因素患病率和全因死亡率均高于西方人群,而本次研究的目标人群是符合西方肥胖标准的肥胖人群(BMI超过30 kg/m2),这部分患者往往承受更大的心血管代谢疾病负担,且目前缺乏有效的药物治疗方案。
而玛仕度肽9mg有望成为国内首个针对更高基数肥胖人群的减重药物。
参考资料:
1.减重降糖双达标|玛仕度肽中国2型糖尿病II期临床研究结果在国际权威糖尿病期刊Diabetes Care发表
2.信达生物宣布玛仕度肽 (IBI362) 高剂量9 mg中国肥胖III期临床研究GLORY-2完成首例受试者给药
3.后浪森林·GLP-1周 | 礼来族系!与替尔泊肽一藤之瓜的信达生物玛仕度肽
4.头对头司美格鲁肽!信达启动玛仕度肽(GCGP/GLP-1RA)III期临床,用于2型糖尿病合并肥胖
5.玛仕度肽:礼来启动减重适应症美国二期临床
6.药融云数据库
推荐阅读:GLP-1药物有哪些?
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论