
疫苗是最成功和最具成本效益的全球卫生干预措施之一,每年在全球范围内预防数百万人死亡。据世卫组织统计,2021年疫苗供应量高达约160亿剂,总值1410亿美元,这几乎是2019年疫苗市场供应量(58亿剂)的三倍,是2019年市场价值(380亿美元)的近三倍半。
这一增长主要是由COVID-19疫苗推动。这表明针对卫生需求扩大疫苗生产具有巨大潜力。同时,疫苗领域依然存在庞大的未满足医疗需求,包括需要开发具有更广泛保护力的疫苗,以及针对目前尚未有疫苗被批准的病原体的新型疫苗等。
创新疫苗与辉瑞PK,撬动70亿美元市场
在整个疫苗领域,细菌疫苗的发展困难重重,原因在于细菌复杂程度高、致病机理多样、抗原选择难度大。因此在大多数情况下,细菌疫苗由多种复杂组分构成,需要考虑多种因素的相互作用,开发难度高。
另一方面,抗生素的使用削弱了人们对于细菌感染的预防意识。而近年来,细菌耐药性的出现使传统抗生素在一些情况下已经无法发挥作用,加上抗生素研发周期较长,新型抗生素研发领域发展滞后。细菌疫苗作为预防细菌感染的有效手段,可减少感染性疾病的发生以及抗生素的使用,其重要性越发凸显。
其中,肺炎球菌性疾病(PD)已被世界卫生组织列为需“极高度优先”使用疫苗预防的疾病。肺炎球菌性疾病是全球严重的公共卫生问题之一,也是导致中国儿童及成年人发病和死亡的重要病因。目前临床上肺炎球菌的耐药性问题日益严重,因此,采用肺炎球菌疫苗预防肺炎球菌性疾病并减少细菌耐药性,尤为必要和迫切。
当前全球肺炎球菌疫苗市场由辉瑞的沛儿系列疫苗(Prevnar family)所主导(主要包括Prevnar/Prevenar 13 & 20),沛儿疫苗作为全球畅销疫苗产品2022年销售额达到了63.37亿美元,是2022年全球销售额最高的非新冠疫苗产品之一,约占全球非新冠疫苗销量的14%,2023年前三季度实现48.35亿美元的销售额。虽然国内外已有默沙东、沃森生物、艾美卫信、民海生物等厂家入局,但沛儿疫苗的市场地位依然未被撼动。
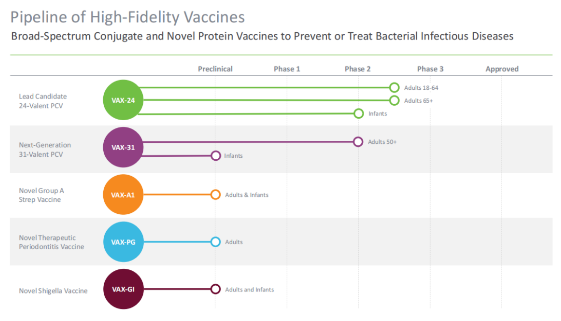
据药融云数据库显示,2023年1月5日,疫苗创新公司Vaxcyte在研的24价肺炎球菌结合疫苗(PCV)VAX-24获得了美国FDA授予的突破性疗法称号。VAX-24被开发用于预防侵袭性肺炎球菌性疾病(IPD,包括脑膜炎和菌血症),旨在覆盖目前流行的大多数肺炎球菌性疾病的血清型,从而提高当前儿童和成人的PCV疫苗的护理标准。基于VAX-24,Vaxcyte还在开发针对31种菌株的VAX-31,旨在覆盖目前美国人口中传播的90%的肺炎球菌性疾病。该公司的目标是撬动全球约70亿美元的肺炎球菌疫苗市场。
背靠强生创新和斯坦福的疫苗新贵
Vaxcyte分拆自美国生物制药公司Sutro Biopharma,最初名为SutroVax。Sutro Biopharma拥有独特的无细胞蛋白合成技术平台,斯坦福大学的James Swartz教授是Sutro公司的创始人,他是无细胞蛋白质合成领域的权威专家。2013年,强生创新通过旗下风险投资基金Johnson & Johnson Development Cooperation(JJDC)与Sutro共同成立了SutroVax。

James Swartz教授 图源:斯坦福大学
2020年5月,SutroVax宣布更名为Vaxcyte,从而更加准确地反映公司专注于疫苗开发的使命。次月,Vaxcyte登陆纳斯达克全球精选市场(NASDAQ:PCVX),IPO募得资金2.875亿美元,当时市值12.65亿美元,到2023年11月21日,该公司总市值已超过48亿美元,几乎是当时的四倍。

截图自companiesmarketcap
目前,Vaxcyte公司通过现代合成技术重新设计高度复杂的疫苗制造方式,包括先进的化学和XpressCF™无细胞蛋白质合成平台,该无细胞蛋白合成平台由Sutro Biopharma独家授权。凭借这一授权,Vaxcyte正在开发多款细菌疫苗产品。
根据许可协议,Vaxcyte有权利用Sutro Biopharma的XpressCF和XpressCF+™平台开发预防或治疗传染病的疫苗产品,Sutro Biopharma则保留发现和开发非传染性疾病的疫苗的权利,例如癌症。Sutro还有资格获得未来Vaxcyte疫苗产品全球销售额4%的特许权使用费,不过这部分潜在的特许权使用费已在2023年8月转让给Blackstone Life Sciences,药融云数据库显示,Blackstone将向Sutro支付1.4亿美元的预付款以及未来高达2.5亿美元的潜在里程碑付款,交易总额为3.9亿美元。

无细胞蛋白质合成与诺奖技术的结合
传统的疫苗生产策略存在生产时间长、病毒原料风险大、免疫原性弱、稳定性差等因素的限制,最终制约了疫苗的安全、快速生产和广泛应用。无细胞蛋白质合成(CFPS)系统使用从细胞中提取的转录和翻译所需物质,可快速生产蛋白质,不受细胞活力的约束,具有高度可优化的开放系统,可用于按需生物制造,是具有前景的疫苗生产工具。
作为一家疫苗创新公司,Vaxcyte致力于设计高保真疫苗,以保护人类免受细菌性疾病的影响。该公司正在利用其独家引进的无细胞蛋白质合成平台为成人和儿童适应症开发潜在的优越和新颖的结合物和蛋白质疫苗。
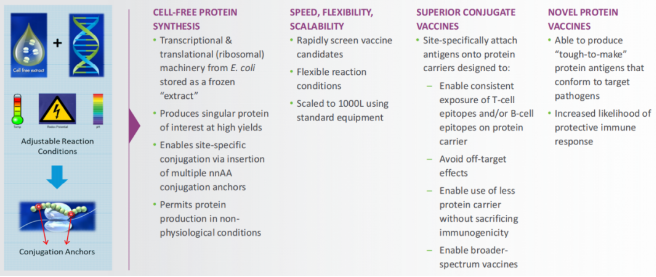
该公司采用的XpressCF无细胞蛋白质合成平台,其核心是专有的无细胞提取物,由高度工程化的细菌细胞系制造而成,其中包含由编码质粒快速表达目标蛋白质的转录和翻译过程所需的原材料。无需像传统基于细胞的表达系统那样为每个新分子构建新的细胞系。
其补充性XpressCF+平台将特定位点非天然氨基酸(nnAA)作为化学手柄,通过“点击化学”(该技术获得2022年诺贝尔化学奖)高效的偶联反应来选择性地连接有效荷载,从而进一步增强了无细胞工艺。这一过程使天然氨基酸保持未修饰的状态,从而得到均匀且质控良好的药物产品。两种平台技术的结合能够筛选nnAAs在蛋白质序列中不同位置的多个变体,从而鉴定出最佳分子。
这种先进化学和无细胞蛋白质表达技术改变了传统疫苗生产的模式,带来多种优势。
◈位点特异性偶联:能够指定抗原(包括多糖)在蛋白质载体上的附着点,以确保B细胞和/或T细胞表位的最佳暴露,从而创建具有增强效力的蛋白质载体。这种对于偶联化学的精确控制可以在不影响整体免疫反应的情况下使用更少的蛋白质载体,添加更多抗原菌株,设计更加广谱的候选疫苗。同时,该技术平台还能够设计出使用标准数量蛋白载体产生更高免疫原性的新型候选疫苗。
◈生产新型蛋白质疫苗:针对业界公认高度复杂的抗原,设计新的候选疫苗,从而解决那些传统技术无法成功开发疫苗的疾病,并借助该平台快速应对新出现的病原体。同时,拥有设计和生产针对目标病原体的“难以制造”的抗原的能力。
◈速度、灵活性和可拓展性:能够快速筛选候选疫苗并生产偶联物,从而加快制造和检验候选疫苗的过程。由于无细胞蛋白质的合成没有细胞活力的要求,所以可以利用更广泛的反应条件来优化蛋白质。这种灵活性能够支持开发现有技术无法实现的新型候选疫苗。另外,该技术平台已在GMP工厂实现了平台的工业化和规模化。
在研产品管线
Vaxcyte对于目标疾病领域和候选疫苗开发的选择基于以下标准:
·聚焦于拥有重大未满足医疗需求的领域
·明确的商业格局和高效的市场采用率
·可接受的生物风险和已建立的临床路径
根据Vaxcyte公司2022年报信息,全球疫苗市场在2022年约为450-500亿美元(COVID-19疫苗除外),预计到2026年将以10% CAGR的速度增长至约670亿美元。世卫组织报告称,过去二十年来,全球疫苗产品(非新冠疫苗)收入的增长速度是治疗性产品的近两倍。其中结合疫苗(包括肺炎球菌结合疫苗)历来是全球非新冠疫苗市场的最大部分(约三分之一)。
Vaxcyte首先选择的便是肺炎球菌结合疫苗(PCV)领域。在许多工业化国家,PCV的广泛使用显著降低了人群中侵袭性肺炎球菌性疾病(IPD)的发病率,但由于“血清型替代”现象,现有疫苗未覆盖的毒株的流行率正在增加。根据2020年发表的研究报告,2017年儿童和成人的IPD发病率中,超过71%都是由PCV13所覆盖的13种菌株以外的菌株引起,因此仍然需要更广谱的疫苗产品。另一方面,受限于传统的偶联化学和载体抑制,新疫苗的开发面临许多复杂因素,尽管新批准了PCV20和PCV15,但依然需要新的技术手段来解决这些难题。
潜在Best-in-Class肺炎球菌结合疫苗,即将推进3期临床:
Vaxcyte利用无细胞蛋白质合成平台开发的24价肺炎球菌结合疫苗VAX-24,解决传统结合疫苗的缺陷,实现了位点特异性偶联,与传统随机偶联相比,精确偶联增强了标准蛋白载体的效力,采用“点击化学”偶联方法,减少对蛋白载体或靶抗原上的关键免疫原性表位的损害。
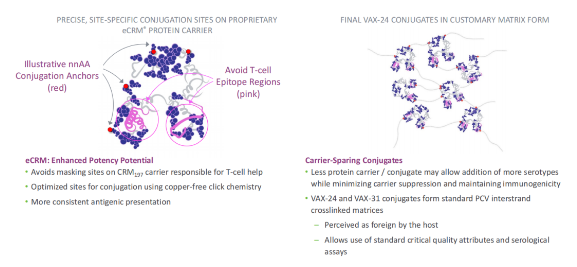
据该公司分析,与目前的标准方案相比,VAX-24有可能在美国成年人中增加14-26%的IPD覆盖率。而Vaxcyte另一款在研的31价肺炎球菌结合疫苗VAX-31在VAX-24的基础上将覆盖范围扩大到31种菌株,估计将覆盖目前美国人群中约95%的IPD流行菌株。
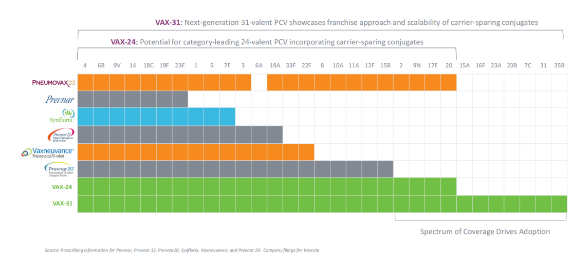
目前Vaxcyte正在开展VAX-24在成人(18-64岁,65岁及以上)和婴儿中用于预防侵袭性肺炎球菌性疾病(IPD)的临床试验。完整的6个月的安全性数据表明,在成人1/2期和2期研究中,VAX-24具有与PCV20类似的安全性和耐受性。与PCV20相比,免疫原性有所提高,且没有证据表明存在剂量依赖性的安全性和耐受性问题。在两项2期研究中,常规2.2微克剂量在所有24种血清型(STs)中均显示出强大的免疫应答(并被确认为3期关键临床的最佳剂量),表明VAX-24具有扩大现有标准治疗范围和提高免疫原性的潜力,支持成人关键3期临床研究的开展。
非肺炎球菌疫苗产品:
药融云数据监测显示:VAX-A1是一种在研的新型结合疫苗,旨在预防由A组链球菌(GAS,又称化脓性链球菌)引起的疾病。A组链球菌在全球普遍存在,是人类细菌感染中最重要的病原之一,每年导致7亿例疾病,包括咽炎或链球菌性咽喉炎,以及某些严重的侵袭性感染,如败血症、坏死性筋膜炎和中毒性休克综合征,也是年幼患者使用抗生素的一个重要原因。目前全球尚未有针对A组链球菌的疫苗获批。VAX-A1已在2021年下半年进入IND-enabling研究阶段。该项目受到了CARB-X(由盖茨基金会、惠康基金会和美国生物防御局组成的机构)的资助,迄今已收到660万美元,潜在资金总额高达1460万美元,包括赠款。
截图来源:药融云全球药物研发数据库
VAX-PG是一种在研的新型蛋白疫苗,针对导致牙周炎的关键病原体,牙周炎是一种慢性口腔炎性疾病,影响着美国约6500万成年人。Vaxcyte在2022年第四季度提名了最终候选疫苗,并继续推进该项目。公司最初的目标是开发一种治疗性疫苗来减缓或阻止疾病进展,但临床试验的结果提示了可能作为预防性免疫接种的潜在信息。
VAX-GI是一种新型的临床前候选疫苗,被开发用于由志贺氏菌引起的痢疾和志贺氏病的预防性治疗。志贺氏菌估计每年影响全世界约1.88亿人,每年导致约16.4万人死亡,其中大多数是中低收入国家的五岁以下儿童。VAX-GI中的核心抗原是IpaB,该蛋白长期以来难以实现足量生产,限制了其商业化应用,Vaxcyte利用无细胞技术大幅提高产量,允许商业化生产。VAX-GI是与马里兰大学巴尔的摩分校合作开发,同时也得到了美国国立卫生研究院两项研究经费的资助。
该公司还拥有其他利用无细胞蛋白质合成平台的早期发现阶段项目,若在临床前研究中获得积极结果,也可推进到IND-enabling研究和临床研究中。
财务状况
自2013年成立以来,Vaxcyte已将大量资源投入到研发、临床前研究、临床试验和生产活动中,以支持产品和技术的开发工作、组织和配备公司、执行业务规划,以及建立知识产权组合,并需要继续筹集资金以支持和扩大此类活动。
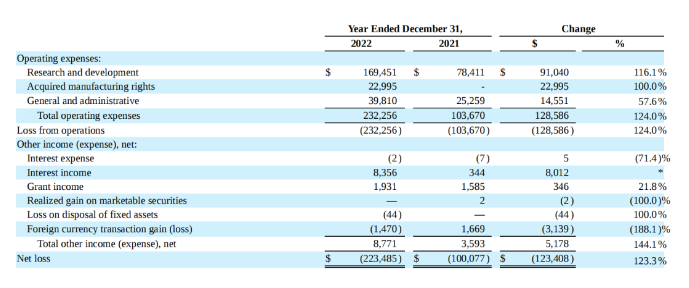
2022年,Vaxcyte全年R&D费用高达1.695亿美元,同比增加116.1%,主要是因为VAX-24和VAX-31项目临床开发费用增加;G&A费用为3981万美元,同比增加57.6%,主要是因为员工增加;2022全年净亏损为2.235亿美元,同比增加123.3%。
2023年前三季度,Vaxcyte公司R&D费用高达2.282亿美元,与去年同期相比接近翻倍,主要是因为VAX-24的3期临床试验相关的制造费用增加,以及为VAX-24和VAX-31的潜在商业发布做准备;随着公司规模不断扩大,员工数量增长,前三季度G&A费用达到4317万美元;前三季度公司净亏损达到2.215亿美元。
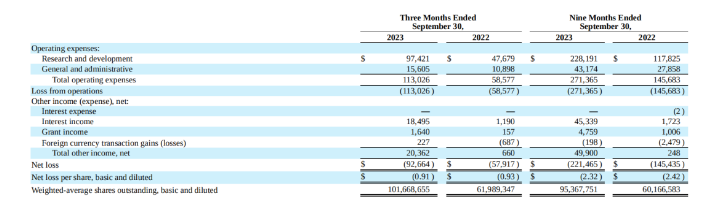
由于尚未有产品销售收入,Vaxcyte每年都在亏损,截至2023年9月30日,该公司累计赤字为7.436亿美元,但同时Vaxcyte拥有14.342亿美元的现金、现金等价物和投资资产,满足未来至少12个月的运营费用和资本支出要求。
参考:
药融云数据库
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露(正文图片均来自企业官方,除非另有说明);
Hu VT, Kamat NP. Cell-free protein synthesis systems for vaccine design and production. Curr Opin Biotechnol. 2023;79:102888. doi:10.1016/j.copbio.2022.102888;
https://www.nature.com/articles/d43747-021-00007-z;等等
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论