
2023年10月11日,美国罗克维尔和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、自身免疫、代谢、眼科等重大疾病领域创新药物的生物制药公司,宣布由信达生物自主研发的抗前蛋白转化酶枯草溶菌素9(PCSK9)单克隆抗体信必乐®(托莱西单抗注射液,研发代号:IBI306)在中国非家族性高胆固醇血症(non-FH)受试者中的III期临床研究(研究代号:CREDIT-1)结果已在国际知名期刊柳叶刀子刊The Lancet Regional Health-Western Pacific在线发表,本文第一作者和通讯作者为北京大学第一医院霍勇教授,这是中国心血管领域创新药的临床研究首次在柳叶刀杂志发表。

此次发表研究结果是基于CREDIT-1研究,一项在中国非家族性高胆固醇血症受试者中评估托莱西单抗的有效性和安全性的随机、双盲、安慰剂对照的III期临床研究(ClinicalTrials.gov, NCT04289285)。研究发现,在长给药间隔下(4周或者6周),托莱西单抗均能显著降低低密度脂蛋白胆固醇(LDL-C)水平,对其他血脂指标也有明显的改善作用,整体数据表明中国非家族性高胆固醇血症患者接受托莱西单抗的治疗后获益明显,安全性良好。
托莱西单抗基本信息
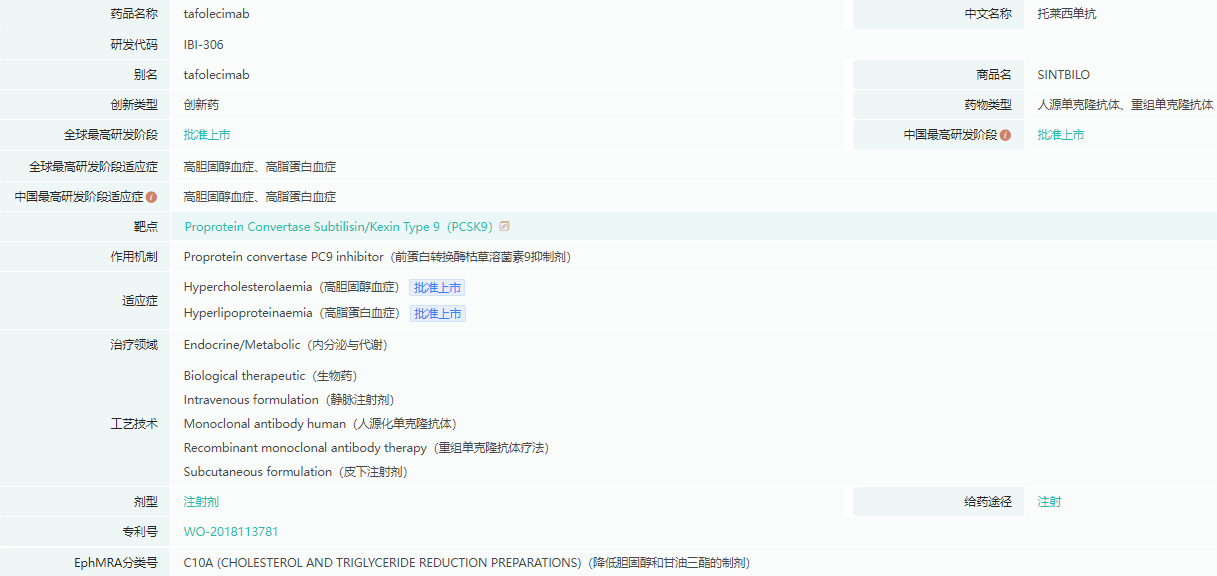
截图来源:药融云全球药物研发数据库
近年来,PCSK9抑制剂作为能强效降低LDL-C水平且安全性良好的新型治疗方案,逐渐得到临床实践的认可。但是中国此前仅有进口品种上市,便利性存在一定局限。今年,信达生物自主研发的信必乐®的上市打破了这一局面,为我国血脂临床管理带来了全新治疗选择,可用于治疗原发性高胆固醇血症(包括杂合子型家族性和非家族性高胆固醇血症)和混合型血脂异常。这是首个获批的中国原研全人源抗PCSK9单克隆抗体,也是国内率先开展长期、大规模、随机双盲三期临床研究的PCSK9抑制剂(CREDIT-1,CREDIT-2和CREDIT-4),并探索和优化了长间隔给药的治疗方案。
在此次发表的CREDIT-1研究中,接受稳定降脂治疗至少4周的非家族性高胆固醇血症受试者按2:2:1:1随机分组,在为期48周的双盲治疗期内分别接受托莱西单抗 450 mg Q4W, 托莱西单抗 600 mg Q6W, 安慰剂450 mg Q4W以及安慰剂600 mg Q6W的治疗。研究的主要终点为第48周时LDL-C水平相对于基线的百分比变化。
研究共入组618例受试者,614例受试者接受至少一次给药。
研究结果显示,托莱西单抗450 mg Q4W和600 mg Q6W均可显著降低LDL-C水平。第48周时,与安慰剂组相比,托莱西单抗450 mg Q4W组的LDL-C水平较基线百分比变化的组间差异为–65.0%(97.5%CI: –70.2%, –59.9%;P<0.0001),托莱西单抗 600 mg Q6W组的LDL-C水平较基线百分比变化的组间差异为–57.3%(97.5%CI: –64.0%, –50.7%; P<0.0001)。
托莱西单抗450 mg Q4W组中,87.8%的受试者的LDL-C水平降低50%以上;91.7%的受试者的LDL-C <1.8 mmol/L;83.4%的受试者的LDL-C <1.4 mmol/L。相应的安慰剂组中受试者比例分别仅为1.0%,7.1%和1.0%。
托莱西单抗600 mg Q6W组中,71.8%的受试者的LDL-C水平降低50%以上;82.1%的受试者的LDL-C <1.8 mmol/L;68.7%的受试者的LDL-C <1.4 mmol/L。相应的安慰剂组受试者比例分别仅为2.0%,9.9%和2.0%。
同时,与安慰剂相比,托莱西单抗的两个给药方案均能降低非高密度脂蛋白胆固醇(non-HDL-C)、载脂蛋白B(ApoB)和脂蛋白a(Lp(a))的水平。研究期间,托莱西单抗总体安全性良好,与托莱西单抗前期研究结果和已上市的PCSK9单抗的安全性特征相似。
信达生物制药集团临床开发副总裁钱镭博士表示:“托莱西单抗在中国非家族性高胆固醇血症受试者中展现了显著的疗效和良好的安全性,特别值得关注的是此次CREDIT-1是一个长达一年的随机对照研究,展示了托莱西单抗长期应用的良好疗效与安全性,对临床实践的指导意义巨大。其研究结果顺利发表在国际高水平的医学期刊上,一方面体现了研究的重大临床意义,另一方面也体现了我国研究者卓越的临床研究水平和信达生物扎实的研发能力。信必乐®已在中国获批上市,我们希望这款高质量的生物药惠及中国的广大高胆固醇血症患者。”
参考资料:
1.文章来源:信达生物
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论