
近日,美国FDA的内分泌和代谢药物咨询委员会(EMDAC)一致投票否决了 Intarcia Therapeutics关于 2 型糖尿病研究性药械结合产品(ITCA 650)的上诉。理由是存在安全性和药物输送问题。
19 名委员发现植入式药物装置组合的益处并没有超过其潜在副作用,特别是治疗组的患者急性肾损伤的高发生率。
Intarcia 成立于 1995 年,起初名为“ BioMedicines”,估值曾一度接近 50 亿美元。十多年来,Intarcia 一直致力于研发ITCA 650 并使其获批,它可将艾塞那肽(Byetta)输送至患者体内。
Intarcia Therapeutics的心脏代谢临床管线拥有6个候选药物,包括曾两次被FDA拒绝的ITCA 650,其他5项资产均处于临床前阶段,将用于治疗2型糖尿病、非酒精性脂肪性肝炎和肥胖症。
然而,今年8月底,Intarcia 宣布已将其资产出售给一家名为“ i2o Therapeutics ”的私人公司。
i2o Therapeutics研发管线
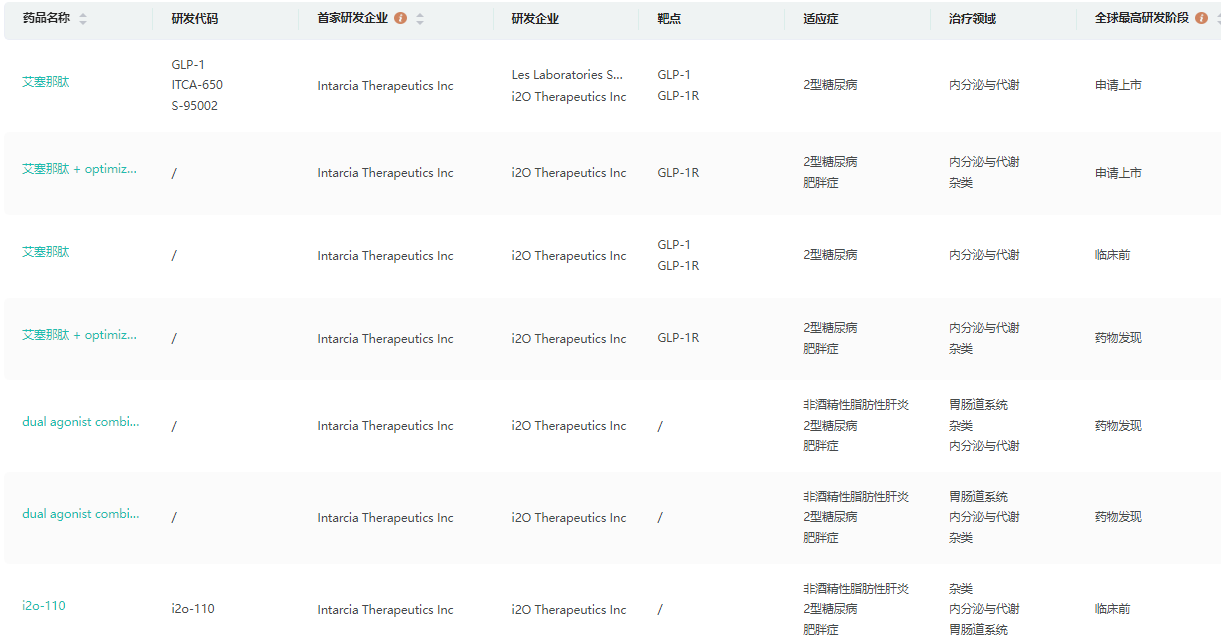
截图来源:药融云全球药物研发数据库
与此同时,i2o Therapeutics宣布已完成4600万美元A轮融资,推进专利药物和创新给药平台的研发,尤其是多肽和基于 GLP-1 的组合肽;还任命Kurt Graves为新任董事长、总裁兼首席执行官。
关于ITCA 650
ITCA 650是一款火柴大小的迷你渗透泵,可放置在患者的腹部。它使用 Intarcia 专有的 Medici 药物递送系统,在六个月内持续将治疗分子输送到患者皮肤下方。该药物装置组合旨在减少注射频率并提高患者治疗依从性。ITCA 650 的活性成分是已获批药物艾塞那肽,与诺和诺德的司美格鲁肽同属 GLP-1 受体激动剂。
2015 年,Intarcia 对ITCA 650 进行的III期研究发现,它在降低血糖方面优于默克公司的 Januvia 。但Wegovy和 Ozempic,近年来也在 2 型糖尿病治疗中取得了可喜的成果,并且由于其减肥效果而大受欢迎。
ITCA 650在 2017 年和 2020 年因安全担忧而遭到拒绝后,美国联邦监管机构给了 Intarcia 一个机会,召开关于该植入物的公共咨询委员会听证会。
Intarcia 在上诉中辩称,Wegovy 等其他 GlP-1受体激动剂虽然安全性不太明显,但它们依然获得了批准。Intarcia 还强调了其设备组合可帮助患者保持用药依从性。但是FDA 审查人员对 ITCA 650 的安全性依然感到担忧。
最后,专家们认为,关于ITCA 650的安全性还有很多不确定性,需要更多数据支持,他们建议Intarcia可以进行更多试验收集更多数据。
关于i2o Therapeutics
i2o Therapeutics就是一家基于新型口服生物制剂给药平台成立的生物技术公司,致力于研发传统上仅限于注射治疗的安全有效的口服制剂,旨在通过全口服疗法和植入式疗法治疗 2 型糖尿病、肥胖症及相关疾病,最初的重点是开发一种新型GLP-1类似物的口服制剂。
参考资料:
1.https://www.biopharmadive.com/news/intarcia-i2o-diabetes-FDA-advisery-committee/694434/
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论