
9月13日,RNAi治疗公司Alnylam Pharmaceuticals, Inc.(纳斯达克代码:ALNY)宣布,关于FDA心血管和肾脏药物咨询委员会(CRDAC)的讨论结果,该会议讨论了研究性RNAi疗法patisiran(商品名onpattro)的补充新药申请(sNDA), 用于治疗转甲状腺素蛋白介导(ATTR)淀粉样变性的心肌病。
CRDAC以9:3的投票结果认为,patisiran治疗ATTR淀粉样变心肌病的益处大于其风险。FDA预计在2023年10月8日前针对此申请完成监管审查。

FDA CRDAC独立专家小组做出的积极决定是基于对支持patisiran sNDA的数据进行的讨论,其中包括APOLLO-B 3期研究的阳性结果,该研究表明,与安慰剂相比,sNDA对ATTR淀粉样变性合并心肌病患者的功能能力、健康状态和生活质量产生了有利影响。分别通过6分钟步行试验(6-MWT)和堪萨斯城心肌病问卷总体总结(Kansas City Cardiomyopathy Questionnaire Overall Summary, KCCQ-OS)评分测定。
CRDAC向FDA提供独立的专家意见和建议,用于治疗心血管和肾脏疾病的上市和研究药物。CRDAC的投票虽然不具有约束力,但FDA将在决定patisiran的潜在扩大适应证时考虑CRDAC的投票。

Patisiran是Alnylam的核心产品之一,是全球首款获得FDA批准的RNAi疗法(2018年8月获批),用于治疗成人遗传性ATTR淀粉样变性的多发性神经病变。该药物2022年全年的销售额为5.58亿美元,2023H1营收1.94亿美元。
在研管线(部分)
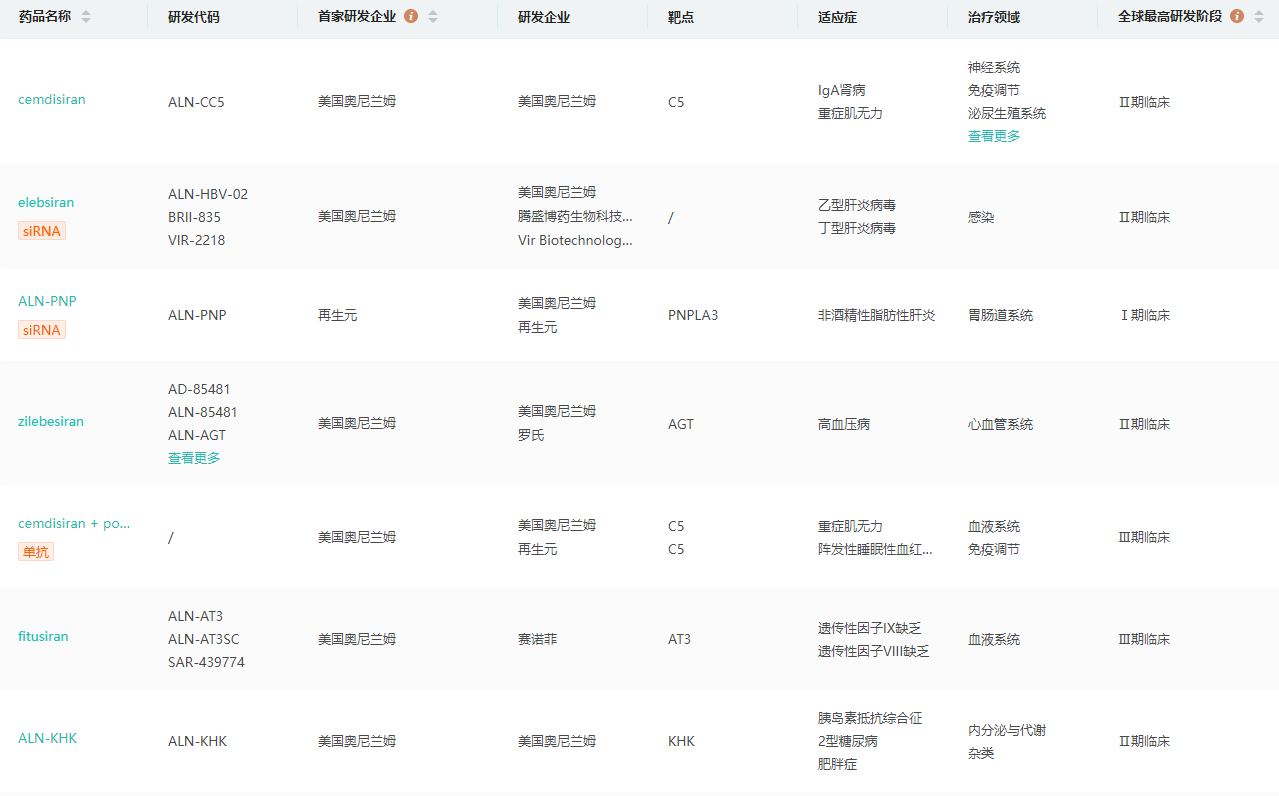
截图来源:药融云全球药物研发数据库
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论