
9月13日,Eiger BioPharmaceuticals(Nasdaq:EIGR)是一家专注于开发罕见代谢疾病创新疗法的商业阶段生物制药公司,宣布决定停止用于慢性丁型肝炎(CHD)患者的聚乙二醇干扰素lambda的3期LIMT-2研究,该决定是基于数据安全监测委员会(DSMB)在其季度安全审查后对该研究的建议。
在2023年9月7日的内部交流中,DSMB建议停止LIMT-2研究,原因是观察到4名患者出现肝胆事件,导致肝功能失代偿。就在几个月前,该公司解雇了25%的员工,并削减了该项目的研发支出。
受到研发终止利空影响,公司股价盘前大跌超过50%,市值仅剩0.15亿美元。2023年中报显示,公司营收851万美元,研发费用支出3614万美元,净利润亏损4347万美元,在手现金及等价物2300万美元。

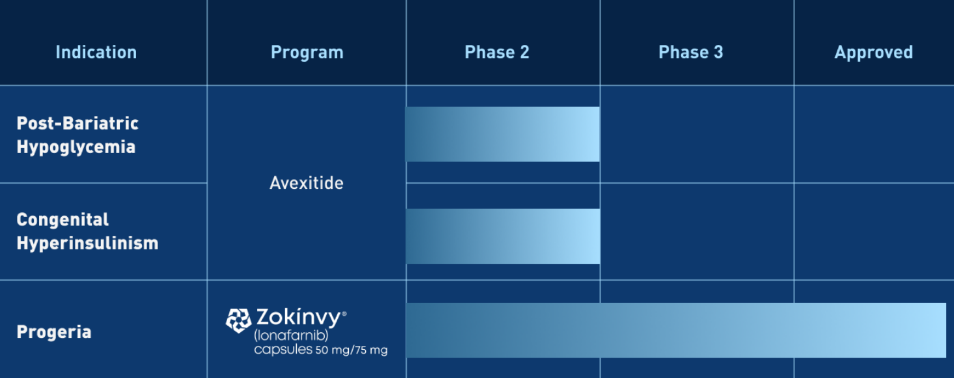
“这项研究的终止令人失望,特别是对于治疗选择有限的慢性丁型肝炎患者,”Eiger BioPharmaceuticals首席执行官David Apelian博士表示,“我们将与FDA和我们的调查人员密切合作,为了患者安全,有序地终止LIMT-2研究。当我们展望Eiger的未来时,我们将继续执行今年6月29日宣布的战略规划,并寻求所需的财务资源,以推进公司在减肥后低血糖(PBH)和先天性高胰岛素血症(HI)的Avexitide开发活动。我们将继续评估我们抗病毒类资产的战略合作选择,但Eiger不再与潜在合作伙伴积极讨论聚乙二醇干扰素lambda的全球许可。”

Eiger BioPharmaceuticals是一家商业阶段的生物制药公司,专注于开发罕见代谢疾病的创新疗法。Eiger的主要候选产品avexitide是一种特性良好的GLP-1拮抗剂,正在开发用于治疗减肥后低血糖(PBH)和先天性高胰岛素血症(HI)。Avexitide是唯一一种被FDA认定为突破性疗法的PBH药物。

总结
在2022年3月17日,Eiger对外公布了单剂量聚乙二醇干扰素Lambda用于新冠治疗的三期临床数据,最高可降低60%新冠死亡风险,可惜的是用于慢性丁型肝炎(CHD)患者的聚乙二醇干扰素lambda的3期LIMT-2研究,因为安全问题以失败告终。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论