 近期,FDA批准了百健(Biogen)和Sage Therapeutics公司共同开发的Zurzuvae(zuranolone)上市作为治疗产后抑郁症的首款口服药物,但拒绝了对重度抑郁症(MDD)治疗的上市批准。
近期,FDA批准了百健(Biogen)和Sage Therapeutics公司共同开发的Zurzuvae(zuranolone)上市作为治疗产后抑郁症的首款口服药物,但拒绝了对重度抑郁症(MDD)治疗的上市批准。
截图来源:药融云全球药物研发数据库
据《财富》杂志报道,在Zurzuvae问世之前,只有一种经FDA批准的治疗产后抑郁症(PPD)的药物——Zulresso (brexanolone),但由于必须在医院静脉注射,许多女性无法获得这种药物。

Sage首席商务官Chris Benecchi在之前的采访中告诉媒体, Zurzuvae也标志着目前的治疗模式发生了重大变化,目前的治疗模式由长效药物组成,通常在6到8周内显示出疗效。然而,由Biogen和sage联合开发的速效药片可以在短短三天内改善症状。Zurzuvae是一种神经活性类固醇,作为GABA-A受体的正变构调节剂。体内GABA水平较低与抑郁症有关。这两家公司预计将在今年第四季度推出Zurzuvae,并将其列为美国缉毒局(U.S. Drug Enforcement Administration)的管制药物。
Biogen和Sage支持Zurzuvae的新药申请,并对PPD和重度抑郁症(MDD)进行了III期临床试验,两者都达到了主要和次要终点。根据两家公司的说法,在PPD患者的SKYLARK试验中,剂量为50毫克的Zurzuvae在治疗15天后显示出“临床意义和统计上显著的抑郁症状改善”。Zurzuvae“总体耐受性良好”,所有治疗中出现的不良事件(teae)的严重程度均为轻度或中度。
Sage Therapeutics的研发管线
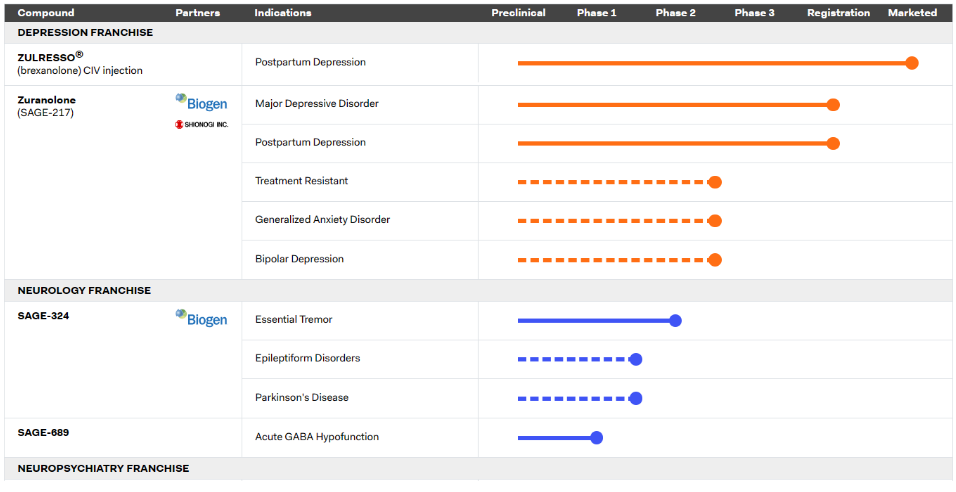
Sage和Biogen在2022年2月报道,在重度抑郁症的CORAL研究中,Zurzuvae与标准护理抗抑郁药物一起使用,在治疗三天后,抑郁症状有统计学意义上的显著减轻,这种效果在两周后持续。Zurzuvae再次得到了很好的验证。尽管有积极的数据,FDA周五晚些时候回复了一份完整的回应信(CRL),声明该申请没有提供“有效的实质性证据”来支持其批准对重度抑郁症的治疗,并且需要另一项研究。
在一份事先准备好的声明中,百健首席执行官Chris Viehbacher表示,合作伙伴将“彻底审查FDA关于在重度抑郁症(MDD)新药中使用zuranolone的反馈,以确定下一步的措施。
在Viehbacher的领导下,Biogen正在进行转型。今年1月,Viehbacher接替Michel Vounatsos新任CEO,后者的任期因FDA批准阿尔茨海默病药物Aduhelm而受到争议。1月6日,百健的第二款阿尔茨海默病药物leqembi与卫材(eisai)合作获得批准,该药物于7月获得传统批准,Viehbacher的任期有了一个良好的开端。今年4月,FDA批准了该公司的Qalsody作为肌萎缩性侧索硬化症的第四种治疗方法,也是第一个针对这种疾病的基因形式的治疗方法。
根据Future market Insights的数据,抑郁症是生物制药行业的大生意,到2032年,全球抑郁症治疗市场预计将达到168亿美元。重度抑郁症是其中更大的一部分,根据美国国家心理健康研究所进行的一项调查,估计2021年有2100万美国成年人至少经历过一次重度抑郁症发作。Sage首席执行官Barry Greene在称赞Zurzuvae被批准用于PPD的同时表示:“关于重度抑郁症的CRL,我们对患者感到非常失望,特别是在当前的精神健康危机和数百万重度抑郁症患者努力寻找症状缓解的情况下。”
参考资料:
公司官网
药融云数据库
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论