
7月20日,美国食品和药物管理局(FDA)宣布第一三共公司研发的奎扎替尼(quizartinib)获得批准用于治疗和辅助诊断罕见的FLT3-ITD阳性的急性髓性白血病(AML),由此AML患者首次有了一线治疗选择。然而该药物QT 间期延长、心搏过速和心脏骤停的发生率较高,具有潜在的致死风险,FDA对Quizartinib添加“黑框警告”!警示心脏疾病事件风险发生!
奎扎替尼全球研发进度
 图片来源:药融云全球药物研发数据库
图片来源:药融云全球药物研发数据库急性髓性白血病(AML)是一组高度异质性疾病,其发病机制基于各种基因突变,其特征是髓系造血祖细胞增殖失控、分化受损和凋亡。FMS样酪氨酸激酶-3(FLT3)突变是AML患者最常见的基因突变之一,与AML复发风险高和预后不良有关,大约30%的初治AML患者发生FLT3突变。
quizartinib主要与FLT3受体的ATP结合结构域相邻区域中的非活性构象结合发挥抑制效应,具有靶向抑制FLT3-ITD的高效性、特异性及持久性。目前quizartinib已被批准用于FLT3-ITD阳性的AML患者与化疗的联合治疗以及初始治疗后的维持性单药治疗[1]。
该药物2019年6月就曾在日本获批,但在日本获批3天之后,FDA认为第一三共提交的数据或有偏倚拒绝了其申请。多年来第一三共为获得批准提供了更多的临床数据,FDA允许给予quizartinib优先审查权。2023年4月21日,第一三共宣布FDA将美国《处方药使用者付费法案》(PDUFA)日期延长3个月至7月24日,需要有更多时间审查其FLT3药物奎扎替尼的NDA,审查本申请中包含的拟议风险评估和缓解策略(REMS)的更新请求。直至2023年7月21日,FDA宣布批准quizartinib上市,用于治疗FLT3-ITD突变的初诊AML成人患者。同时,FDA还批准LeukoStrat CDxFLT3突变测定法作为quizartinib的伴随诊断。且FDA对于quizartinib应用于QT间期延长、尖端扭转性室性心动过速和心脏骤停提出了黑框警告[2]。
 图片来源:FDA
图片来源:FDAQuANTUM-First试验(NCT02668653)中将539例FLT3- ITD阳性的初诊AML患者随机(1:1)分配到quizartinib组(n = 268)或安慰剂组(n = 271),使用quizartinib/安慰剂联合标准阿糖胞苷和蒽环类药物诱导和巩固化疗,并在巩固后继续维持单药治疗组,并比较二组患者的生存期。结果显示。与单纯标准化疗相比,死亡风险降低22 %(HR = 0.78 [ 95 % CI : 0.62-0.98 ],双侧p=0.0324)。虽然完全缓解(CR)率在两组中相似,但接受quizartinib的患者在38.6个月的( 95 % CI:21.9,NE)时,CR的中位持续时间比接受安慰剂加标准化疗的患者(95% CI:8.8 ~ 22.7)的12.4个月长2倍以上[3]。
QuANTUM-First试验(NCT02668653)详情
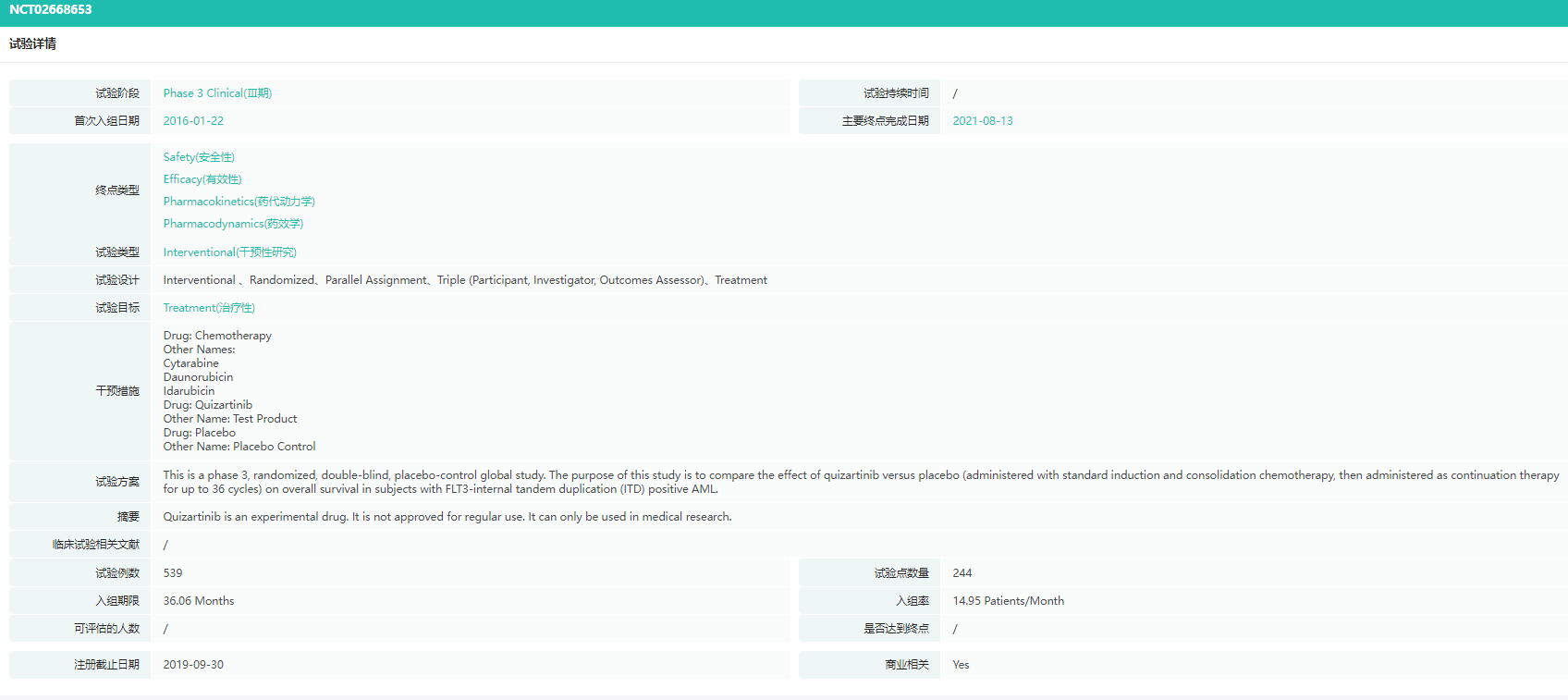 图片来源:药融云全球临床试验数据库
图片来源:药融云全球临床试验数据库
在1081例接受过quizartinib治疗的AML患者中,约0.2 %的患者发生尖端扭转型室性心动过速,0.6 %的患者发生心搏骤停,其中0.4 %的患者发生致命性后果,0.1 %的患者发生心室颤动。这些严重的心律失常主要发生在诱导期。
在QuANTUM-First试验中,265例初诊FLT3 - ITD阳性AML患者接受quizartinib治疗,每天1次(35.4 mg配合化疗,26.5 ~ 53 mg维持治疗)以评估quizartinib的安全性。在接受quizartinib治疗的患者中,14 %的患者报告了紧急QT间期延长事件,其中3.0 %的患者发生了3级或4级事件,2.3 %的患者QTcF>500 ms,10 %的患者较基线QTcF增加>60 ms。临床试验排除QTcF≥450 ms或其他可增加QT间期延长风险或心律失常事件(如NYHA心功能分级Ⅲ或Ⅳ级充血性心力衰竭、低钾血症、长QT间期综合征家族史等)的患者。因此避免在严重心脏病、近期心肌梗塞、心力衰竭、不稳定型心绞痛、缓慢性心律失常、快速性心律失常、未控制的高血压、高度房室传导阻滞、严重的主动脉瓣狭窄或心肌梗死患者中使用。
因其存在QT 间期延长、心搏过速和心脏骤停的严重风险,quizartinib只能通过一项名为“VANFLYTA 风险评估和缓解策略”的限制性计划提供。quizartinib只能由经过认证的医疗服务提供者和 3 家药店处方和配发[4]。

总结
长期以来,对于所有急性髓系白血病患者,5年总生存率约为30 %。通常降低生存率的原因是许多AML患者的确诊时间较晚,且这些患者中的风险突变很差,所以像quizartinib这样的药物极有可能改变AML的自然史。
目前已获批与标准化疗联用作为一线治疗AML的药物还有Agios旗下药物IDH1/2抑制剂Idhifa (enasidenib)单药用于难治复发的IDH2阳性AML患者,Tibsovo(ivosidenib)单药用于IDH1阳性初治75岁以上或因并发症无法使用高强度化疗AML患者;辉瑞研发的Hedgehog抑制剂Daurismo(glasdegib)与低剂量阿糖胞苷(LDAC)化疗联用,治疗新确诊的75岁以上,或因慢性健康问题和疾病无法使用高强度化疗的AML患者。Chimerix在研药物CXCL12/CXCR4抑制剂dociparstat钠(DSTAT)是一种肝素的糖胺聚糖类似物,与强化7 + 3化疗联合开发用于新诊断的AML,目的是提高持久应答率。
随着多个靶向药物获得批准,AML药物治疗市场将会得到很快扩大,期望为AML人群提供更多的治疗选择。
参考资料
[1]AC220 is a uniquely potent and selective inhibitor of FLT3 for the treatment of acute myeloid leukemia (AML).[J].Blood, 2009.
[2]Erba HP, Montesinos P, Kim HJ, et al. Quizartinib plus chemotherapy in newly diagnosed patients with FLT3-internal-tandem-duplication-positive acute myeloid leukaemia (QuANTUM-First): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023;401(10388):1571-1583.
[3]药融云数据库
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论