4月24日,蓝鸟生物(bluebird bio)宣布已向FDA提交了基因疗法lovotibeglogene autotemcel(lovo-cel)的生物制品许可申请(BLA),用于12岁或以上镰状细胞贫血(SCD)患者。此次BLA包括优先审查请求,如果获得批准,lovo-cel将成为蓝鸟生物获批上市的第三款基因疗法。
蓝鸟生物研发管线
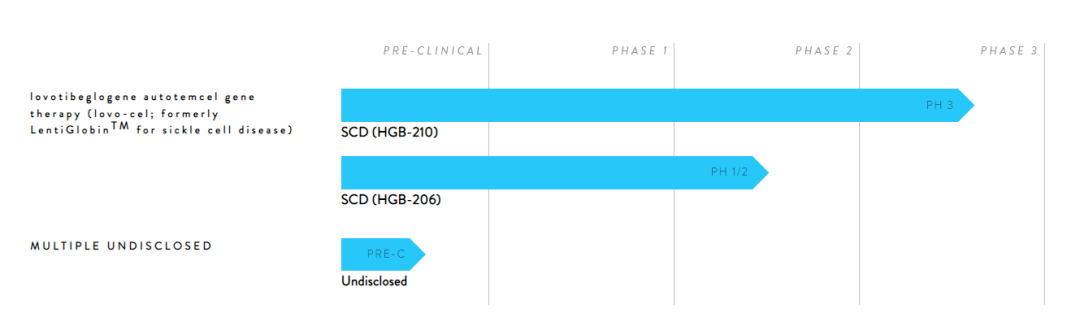
来源:官网
受此消息影响,蓝鸟股价开盘时上涨了约4%。
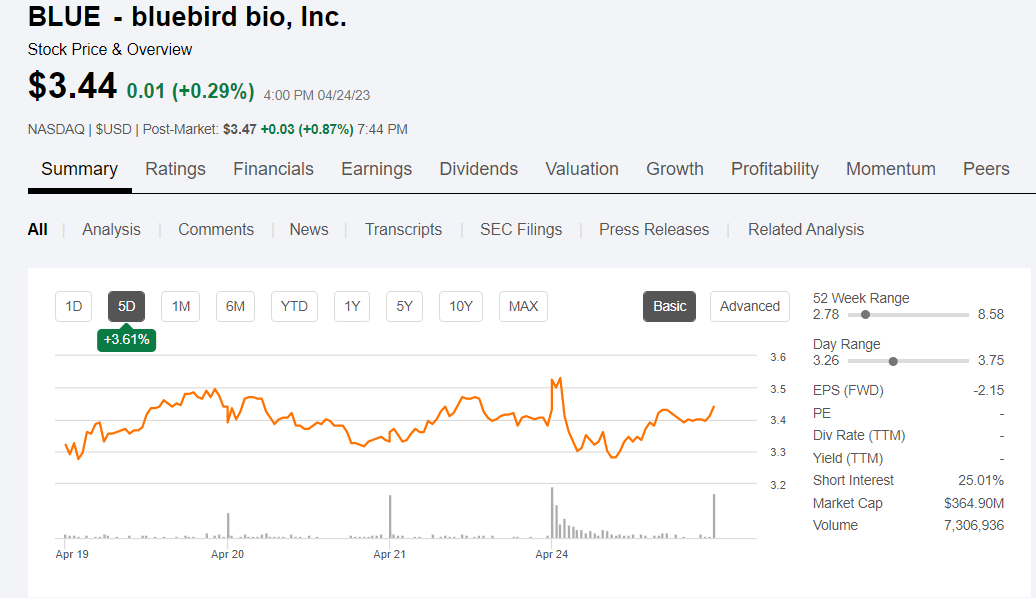
最初,蓝鸟生物期望在2023年第一季度末之前向FDA提交BLA,但是3月底时,这一目标没有实现,并且蓝鸟生物当时还推迟了lovo-cel的BLA申请,导致其股价大跌31%。
lovo-cel药物研发信息(部分,完整内容请进入“药融云数据库www.pharnexcloud.com/?mh”查看)
截图来源:药融云全球药物研发数据库
3月底时,蓝鸟生物公布2022业绩报告:营收360万美元,这主要得益于其已经获批的2款基因疗法——ZYNTEGLO和SKYSONA(《360万美元!蓝鸟生物推出2款重磅基因疗法,第三款提交BLA推迟》)。
β-地中海贫血基因疗法ZYNTEGLO®(betibelogene autotemcel,beti-cel)于2022年8月获批,定价为280万。蓝鸟生物第2款基因疗法SKYSONA®(elivaldogene autotemcel,eli-cel)于2022年9月获批上市,主要用于减缓4-17岁早期活动性脑肾上腺脑白质营养不良(CALD)男孩神经功能障碍的进展,定价为300万美元。
值得注意的是,几周前,Vertex和CRISPR Therapeutics公司向FDA提交了其共同开发CRISPR基因编辑疗法exagamglogene autotemcel(exa-cel)的滚动生物制品许可申请,用于治疗镰刀状细胞贫血病(SCD)和输血依赖性B地中海贫血(TDT)患者。FDA预计在8-12个月后公布审评结果。
蓝鸟生物一份新闻稿中表示,它要求优先审查,如果获得批准,将把FDA的审查时间从10个月缩短到6个月。但是,蓝鸟生物最后证实没有使用优先审评券。
lovo-cel获得的特殊审批认证
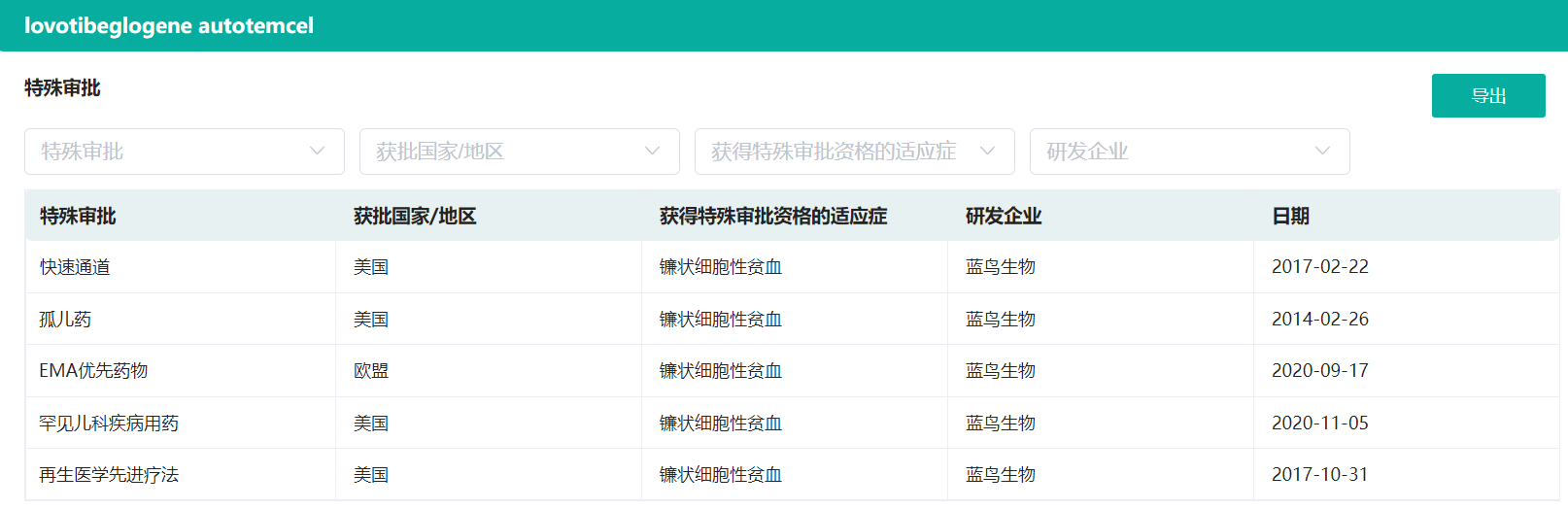
截图来源:药融云全球药物研发数据库
那这样看来,蓝鸟生物的基因疗法lovo-cel或与Vertex/CRISPR Therapeutics的CRISPR基因编辑疗法exa-cel获批时间差不多,就看谁抢先一步占据市场优势。
参考资料:
[1] 药融云数据库
[2] 蓝鸟生物官网
[3] https://endpts.com/on-vertex-and-crispr-therapeutics-heels-bluebird-submits-sickle-cell-gene-therapy-to-FDA/
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论