

药融圈获悉:万泰生物于2023年2月13日公告,公司于2021年9月收到国家药监局(NMPA)核准签发的20价肺炎疫苗(PCV20,20-Valent Pneumococcal Conjugate Vaccine)的《临床试验批准通知书》。近日,20价肺炎疫苗已经启动I期临床试验,并完成首例受试者入组。本次20价肺炎球菌多糖结合疫苗I期临产研究计划入组256名志愿者,试验预计为期25个月,包括全程安全性评价和后续免疫原性评价。
据药融云数据库显示,20价肺炎疫苗为公司与江苏坤力生物制药有限责任公司联合开发,系用肺炎球菌1、3、4、5、6A、6B、7F、8、9V、10A、11A、12F、14、15B、18C、19A、19F、22F、23F和33F型荚膜多糖分别与重组肺炎溶血素共价结合成多糖蛋白质结合物,再将20种多糖蛋白质结合物按一定比例配制成的20价肺炎疫苗,临床前动物实验结果显示该疫苗具有良好的安全性和免疫原性。
截图来源:药融云全球药物研发数据库
药融云数据库显示:《肺炎20价候选疫苗许可使用协议》数据中,此前交易采用许可授权费+里程碑款项+许可费的支付方式,其中:

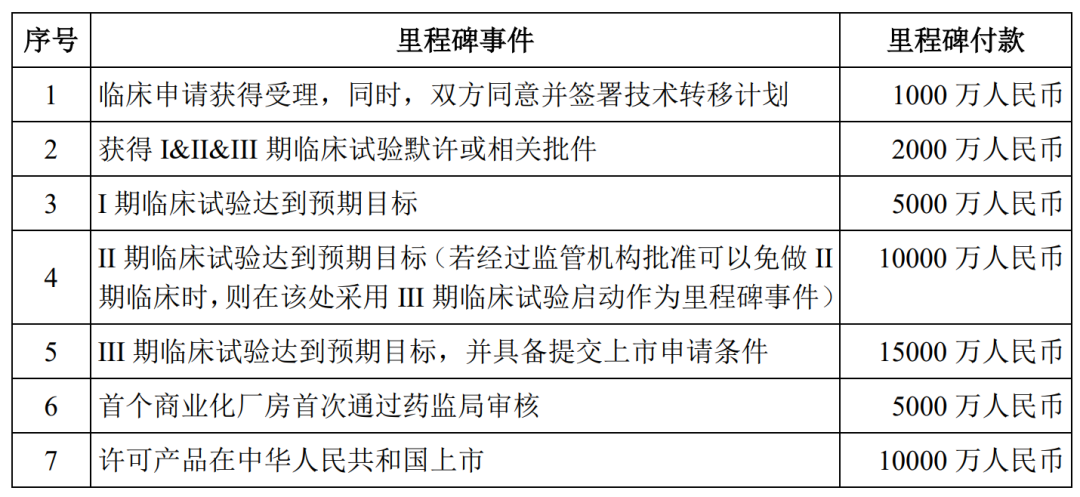
(1)许可授权费:2000万元人民币一次性支付,不可退、不可抵扣;
(2)里程碑款项:需在实现对应的里程碑事件后支付,共计4.8亿元人民币;(3)许可费:许可产品在中国启动首次商业化销售后的11个会计年度内(含首次实现销售收入的当个会计年度)支付,许可费率按净销售额的6%-8%,不同会计年度略有差异。
(a)许可费率。许可产品在中华人民共和国上市后,万泰生物将按如下标 准支付许可费用:i. 该许可产品实现销售收入当年及随后第 1-2 个会计年度,按净销售额的 8%向江苏坤力支付许可费;
ii. 第 3-4 个会计年度,按净销售额的 7.5%向江苏坤力支付许可费;
iii. 第 5-6 个会计年度,按净销售额的 7%向江苏坤力支付许可费;
iv. 第 7-8 个会计年度,按净销售额的 6.5%向江苏坤力支付许可费;v. 第 9-10 个会计年度,按净销售额的 6%向江苏坤力支付许可费。
(b)许可费期限。十个完整年度(自产品正式上市产生第一次连续 销售收入之日算起),在许可产品在中华人民共和国启动首次商业化销售后的 11 个会计年度内(含首次实现销售收入的当个会计年度),万泰生物应根据相 关约定支付许可费,期满后不再支付许可费。
在全球范围内,肺炎球菌肺炎在70岁及以上老年人群中每年预计可导致约50万人死亡、3000万人感染。肺炎球菌结合疫苗是预防球菌所致肺炎的“防病利器”。本次临床研究应用的肺炎球菌结合疫苗(PCV20)是新一代我国自主研发的20价肺炎疫苗,采用了新型载体蛋白。用于6周龄及以上人群进行主动免疫接种,预防由疫苗中20种肺炎链球菌血清型引起的侵袭性疾病和肺炎。


此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
BD交易|万泰生物5亿元引进20价肺炎多糖蛋白结合疫苗;
厦门万泰20价肺炎球菌多糖结合疫苗I期临床试验启动会在阜圆满召开,https://mp.weixin.qq.com/s/0erilVIPbfTM9tmRBE_pyw;等等。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论