
刚刚,NMPA发布2023年01月31日药品批准证明文件送达信息,本批次共有107个受理号获批,其中包括2个仿制药一致性评价受理号,分别为:
- 福安药业集团宁波天衡制药有限公司,盐酸格拉司琼注射液
- 国药集团致君(深圳)制药有限公司,注射用头孢西丁钠
另有多个产品获批上市,苏州盛迪亚生物医药有限公司(恒瑞医药子公司)注射用卡瑞利珠单抗又一适应症获批,用于晚期肝细胞癌一线治疗。自2019年获批上市以来,卡瑞利珠单抗已获批9个适应症。

截图来源:NMPA官网
此外,福安药业集团庆余堂制药有限公司的酒石酸布托啡诺注射液成功获批,为国内第3家过评。至此,该品种仿制药一致性评价满三家,可入选国家集采。

截图来源:NMPA官网
酒石酸布托啡诺注射液是一款止痛药,适用于治疗各种癌性疼痛、手术后疼痛。恒瑞医药最早在2002年获得该产品的生产批文,此后独占市场10年,据药融云数据统计,酒石酸布托啡诺注射液全国医院2021年销售额超16亿元。
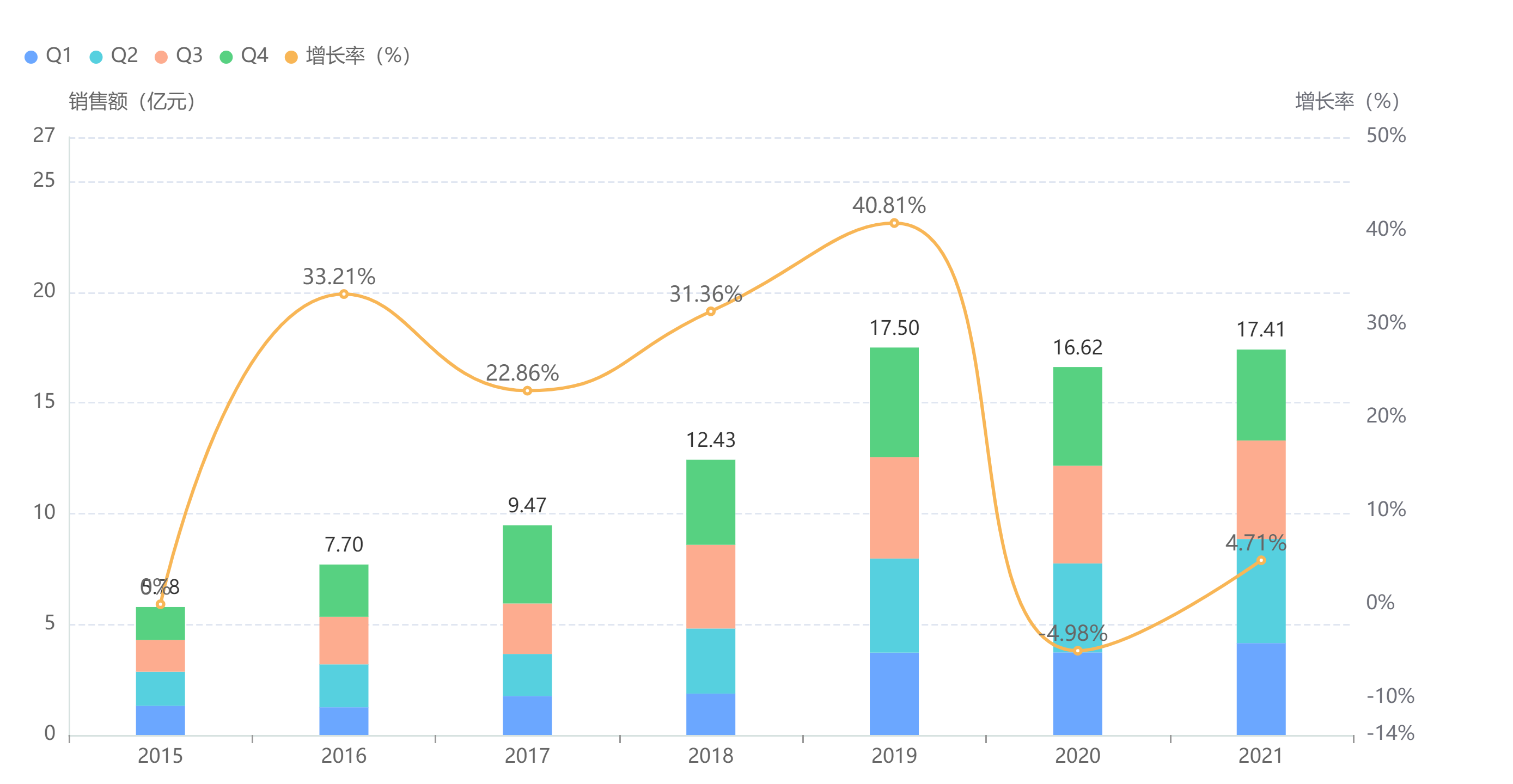
截图来源::药融云全国医院销售(全终端)数据库
2022年11月,国药集团国瑞药业有限公司的2品规酒石酸布托啡诺注射液获批上市(视同过评),打破了恒瑞医药市场独占局面。此次,福安药业集团庆余堂制药有限公司再过评,该品种仿制药一致性评价满三家,达到了“仿制药门槛”,拥有了入选国家集采的资格,在药品集中采购等方面不再选用未通过一致性评价的品种。
截图来源:药融云一致性评价数据库数据库
根据CDE公开信息显示,除上述三家获批外,另有成都苑东生物的该产品处于审评审批中。

截图来源:CDE官网
2023年01月31日药品批准证明文件送达信息


截图来源:NMPA官网
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论