
2022年11月28日,罕见病精准遗传医学领域的领导者Sarepta Therapeutics(纳斯达克代码:SRPT)今天宣布,FDA已经接受了该公司的生物制品许可申请(BLA),以加速批准SRP-9001 (delandistrogene moxeparvovec),该药是一款杜氏肌营养不良症基因疗法。SRP-9001已获得FDA的优先审查,PDUFA日期为2023年5月29日。
受到此消息影响,截止北京时间23点,Sarepta Therapeutics股价121美元/股,涨幅6%,目前100亿美元,今年以来股价累计涨幅近50%。

SRP-9001(delandistrogene moxeparvovec)是一种研究性基因疗法,旨在将目的基因递送到肌肉组织,并且有针对性地产生抗肌萎缩蛋白的有效成分。据药融云数据库显示,2019年底,Sarepta Therapeutics与罗氏达成协议,罗氏获得SRP-9001在美国以外地区的独家权利签署协议,并分担SRP-9001的全球开发成本。Sarepta Therapeutics将获得11.5亿元的首付款(7.5亿美元现金和4亿美元股权的预付款),以及未来可能高达17亿美元的里程碑付款。
Sarepta与罗氏关于SRP-9001的医药交易信息(部分)
截图来源:药融云全球医药交易数据库
杜氏肌营养不良症(DMD)是一种罕见的、致命的神经肌肉遗传病,全球大约每3500—5000名新生男性中就有1人发生。杜氏肌营养不良症是由编码抗肌萎缩蛋白指令的基因发生改变或突变引起的,症状通常出现在婴幼儿中(《关注罕见病!杜氏肌营养不良症药物治疗遇困,基因疗法或是突破点》)。
“我们很高兴地宣布,FDA已接受Sarepta 的 SRP-9001 BLA进行备案和优先审查,”Sarepta Therapeutics总裁兼首席执行官Doug Ingram说,“杜氏肌营养不良症是一种无情的退化性疾病,并且总是致命的,它每天每时每刻都在剥夺儿童的肌肉和功能。我们提交的 BLA 加速批准,以及FDA接受该BLA进行备案和审查,是我们努力尽快为杜氏肌营养不良症患者带来可能改变生命的基因疗法的一个极其重要的里程碑,我们期待着通过审查过程与FDA合作。”
Sarepta拥有治疗杜氏肌营养不良症(DMD)的三款ASO重磅产品——Exondys 51、Vyondys 53和Amondys 45,2022年前三季度实现销售额6.08亿美元(约为43亿人民币),同比增长40%。(1美元 ≈ 7.15人民币)。
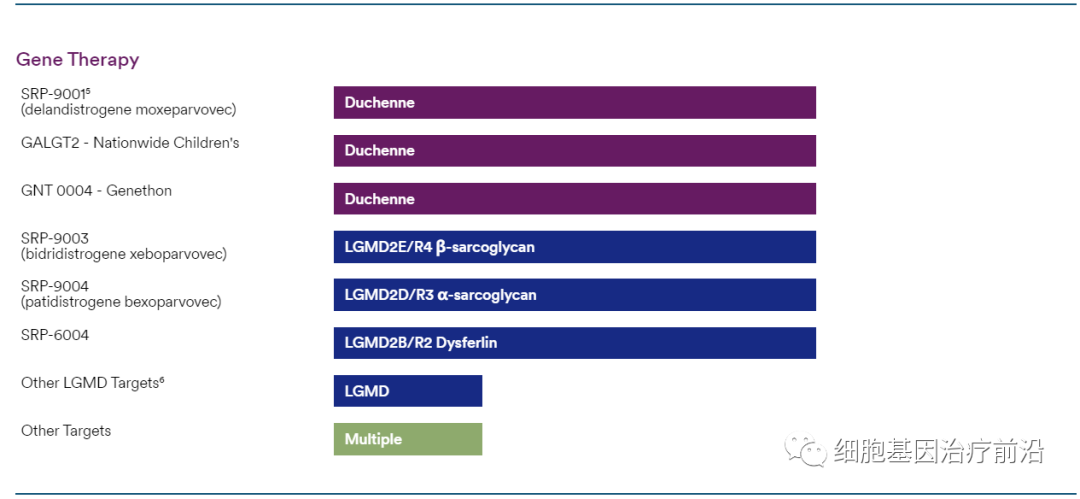
Sarepta的基因治疗和基因编辑管线

此外,辉瑞的杜氏肌营养不良症基因疗法也有进展。
今年4月份,辉瑞公司宣布,美国FDA已经通知该公司,允许其治疗杜氏肌营养不良症基因疗法——fordadistrogene movaparvovec的3期临床试验继续进行,这是一款在研静脉注射基因疗法。这个名为CIFFREO的全球性3期临床试验在去年12月因为在1b期临床研究中一名患者出现致命不良事件而暂停;此后辉瑞对临床试验流程进行了修改,满足了监管要求。
参考资料:
[1] sarepta官网:https://www.sarepta.com/
[2] 药融云数据库:vip.pharnexcloud.com/?zmt-mhwz
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>




























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论