
据统计[1],目前中国已有46款新冠病毒疫苗进入临床试验,21款在境外获批开展Ⅲ期临床试验,灭活疫苗、腺病毒载体疫苗、重组蛋白疫苗等9款疫苗获批附条件上市或紧急使用。国内可获得的疫苗中,尚无新冠mRNA疫苗。中国科学院院士高福此前称,新冠mRNA疫苗将是生物医学的革命化变革,中国应当有所布局。

近日,斯微(上海)生物科技股份有限公司(以下简称“斯微生物”)自主研发的新冠mRNA疫苗——SW-BIC-213在老挝启动Ⅲ期临床试验。该研究为随机、对照、双盲设定,评估作为序贯加强接种对于18岁及以上健康人群的免疫原性和安全性。斯微生物是中国首家在海外开展新冠迭代mRNA疫苗Ⅲ期临床的企业。
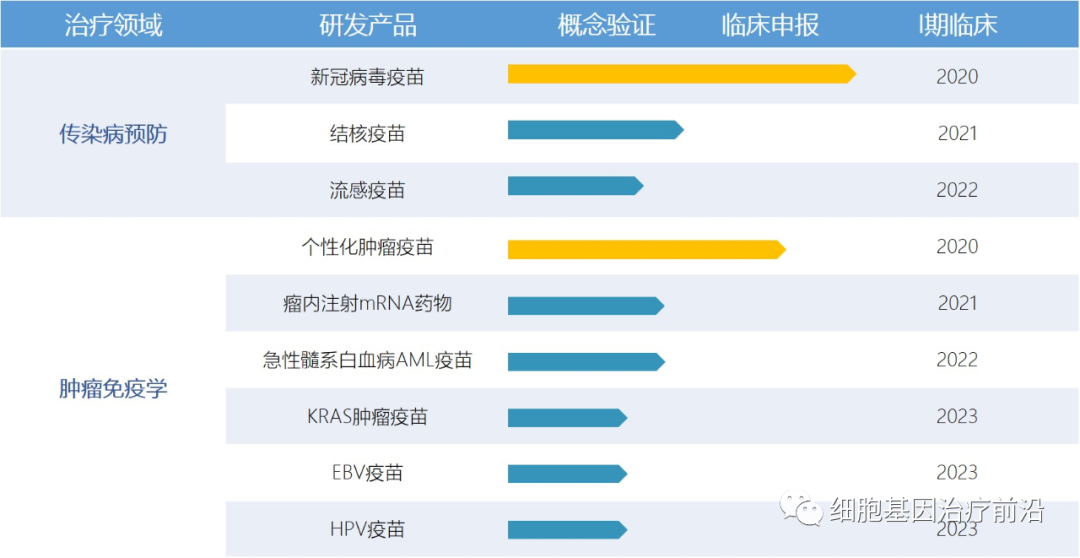
斯微生物产品管线
斯微生物的新冠mRNA疫苗的特点在于,采用了独立知识产权的LPP递送技术。相较之下,目前全球大多数新冠mRNA疫苗均采用LNP递送系统,包括BioNTech、Moderna、艾博生物、艾美疫苗等。
根据老挝Ⅰ期和Ⅱ期临床观察显示,SW-BIC-213安全性良好,无严重不良事件和特别关注的不良事件,接种2针后14天,25μg低剂量组和45μg高剂量组对于Omicron中和抗体滴度分别为康复患者血清的2.0倍和3.3倍。同时,SW-BIC-213在国内完成了I期临床试验,并在云南和上海完成了加强免疫的临床研究。与目前已上市新冠mRNA疫苗相比,免疫原性研究显示,SW-BIC-213对突变株有较强的中和效果,初步验证产品具有良好的安全性和免疫原性。

除了斯微生物,在9月底,艾博生物新冠mRNA疫苗ARCoV在印尼获紧急使用许可(EUA),成为了国内首款在国际上获批临床使用的新冠mRNA疫苗,也是艾博生物在海外获得的第一个EUA,一度引起了圈内热议。但同时也有质疑的声音出现,“印尼是最容易取得EUA的国家之一”。
据药融云数据显示,艾博生物的新冠mRNA疫苗除了在印尼已上市,还在包括中国等多国都处于临床三期试验阶段,其中Indonesia(印度尼西亚)、Mexico(墨西哥)目前还在招募中。
ARCoV临床试验基本信息
截图来源:药融云中国临床试验数据库
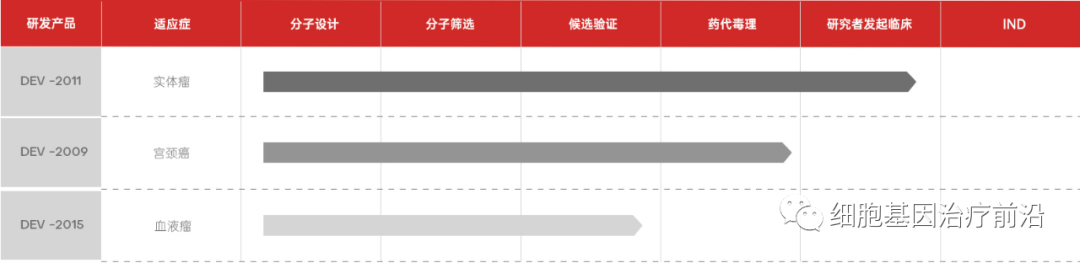
同时,艾博生物还公布了自己的研发管线,除了传染病类型,还包括肿瘤免疫方面。
艾博生物产品研发管线

不管是什么样的声音,最后都要等待数据来表明自己的作用。而目前大流行时间已经来到了第三年的尾声,从全球新冠疫苗的发展来看,也有不少公司已经开始放弃这条管线。(拓展阅读:Novavax新冠疫苗订单取消,富士CDMO获赔1.85亿美元)现在国内还有商业化潜力的因素之一或许是目前还没有一家新冠mRNA疫苗突破重围。而康希诺、石药集团、蓝鹊生物等公司,作为“追赶者”,研发能力和速度并不比跑在前面的公司差。
国内对新冠mRNA疫苗的研发相对于欧美更缺乏沉淀和经验,但奋进的研发人员并没有放弃。期待后续能有更多数据披露。
信息参考:
[1]多条技术路线并行 我国新型新冠病毒疫苗研发取得这些新进展 (zj.gov.cn)
[2]斯微生物微信公众号
[3]艾博生物微信公众号
[4]药融云数据库vip.pharnexcloud.com/?zmt-mhwz
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论