
近日,人福医药发布公告,其子公司宜昌人福收到NMPA核准签发的氯巴占片的《药品注册证书》(批件号:2022S00895、2022S00896;规格:10mg、20mg)。氯巴占片属于儿童罕见病用药,用于治疗儿童难治性癫痫发作,适用于2岁及以上Lennox-Gastaut综合征(LGS)患者癫痫发作的联合治疗,为国内首家获批。

截图来源:人福医药企业公告
此前,氯巴占的缺药问题,一度引起社会的广泛讨论。自20世纪80年代起,氯巴占就已在超过100个国家被用作抗癫痫药物,是国际上广泛批准使用的难治性癫痫老药。不过由于氯巴占具有一定的成瘾性,在我国,氯巴占被列入第二类精神药品受到严格管控。
此前国内暂无该活性成分批准上市销售,也没有进口药获批上市,作为儿童罕见病的“救命药”,众多患儿家属只能从国外代购氯巴占,患者用药难度巨大,存在代购被诉贩毒、代购中断无药可吃等问题。此次宜昌人福的氯巴占片作为国内首仿获批上市,将有力改善这一局面。
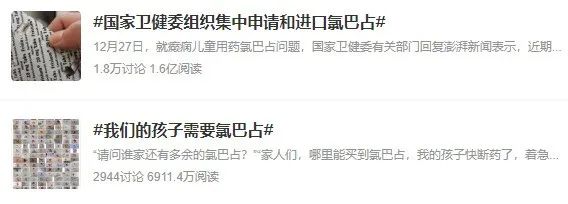
截图来源:微博
2017年发布的《第二批鼓励研发申报儿童药品建议清单》纳入了氯巴占,旨在鼓励研发,满足中国大陆境内尚未注册上市且临床急需的儿童药品。
《第二批鼓励研发申报儿童药品建议清单》
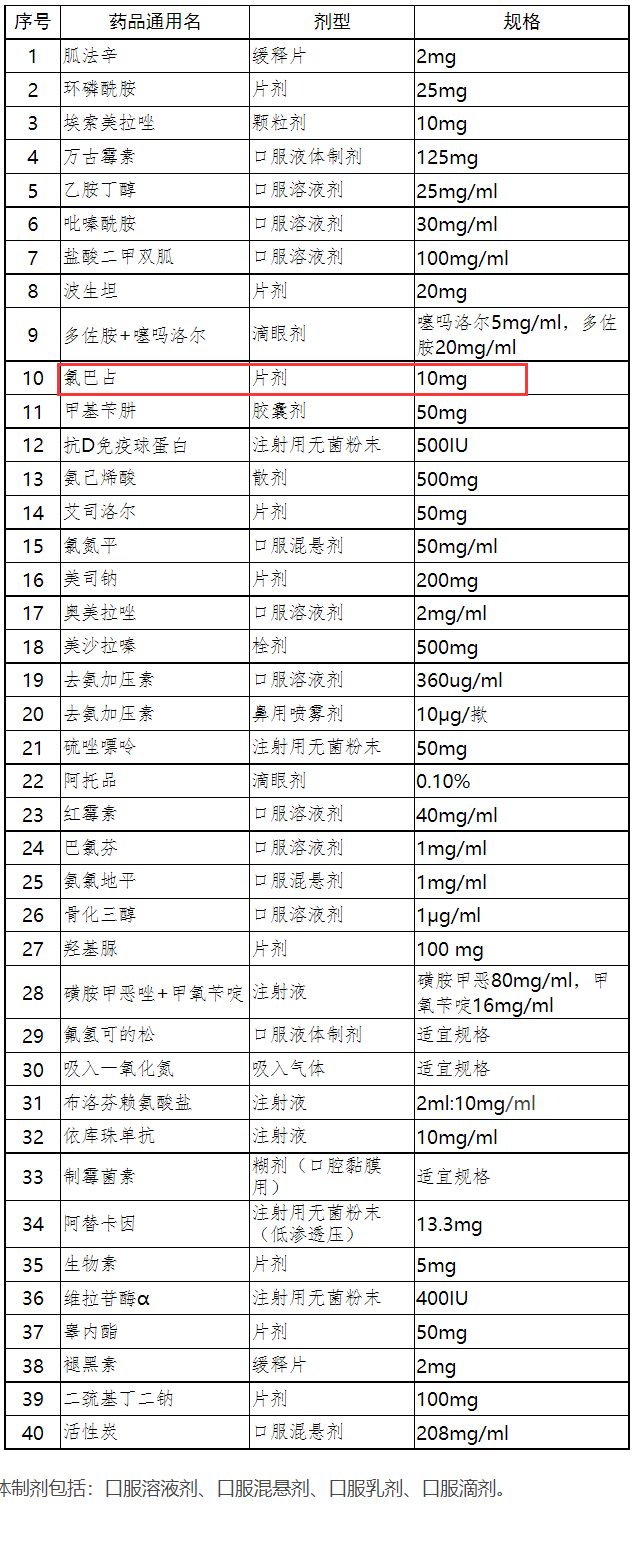
不过国内氯巴占的研发并不理想,这是由于氯巴占开发难度较大,用药主体为儿童,且涉及罕见病领域,受试者招募和入组都比较困难。据药融云数据显示,除人福药业外,另有济南科汇医药的氯巴占片获批临床。值得一提的是,宜昌人福还于今年8月递交了氯巴占口服混悬液的临床试验。
宜昌人福氯巴占口服混悬液审评信息(微信搜索"药融云小程序"进行相关更多数据查询)

截图来源:药融云中国药品审评数据
关于罕见病药物的部分优先政策
2018年5月,国家卫生健康委员会等五部门联合制定了《第一批罕见病目录》,公布了121种罕见病,包括21-羟化酶缺乏症、白化病、血友病等等。
国家发布《第一批罕见病目录》
(发布日期:2018年5月22日)

整理:药融云
《药品注册管理办法》及其配套文件规定,用于防治列入罕见病目录的疾病(国家卫生健康委员会等部门联合发布),具有明显临床价值的创新药和改良型新药,可纳入优先审评审批程序。对纳入优先审评审批程序的临床急需的境外已上市境内未上市的罕见病药品,其上市申请审评时限为70日。
2022年2月9日,国家卫健委官网公布的《对十三届全国人大四次会议第9415号建议的答复》提到,国家卫健委已按照规定适时启动第二批罕见病目录的遴选工作,处于材料审核阶段。截至今年4月,国家卫健委罕见病诊疗与保障专家委员会办公室已经收到了将近200份申请,将按照既定的遴选程序,进行材料审评、专家论证和公示等。
对国内没有批准上市的药品,如临床救治急需,医疗机构可以申请进口少量药品用于救治患者,由国家药监局或国务院授权的省政府批准(目前国务院已授权海南省、广东省等省份)进口。进口氯巴占还应当取得国家药监局核发的精神药品进口准许证。
2022年5月9日,国家药品监督管理局发布中华人民共和国药品管理法实施条例(修订草案征求意见稿)。意见稿提出对批准上市的罕见病新药,在药品上市许可持有人承诺保障药品供应情况下,给予最长不超过7年的市场独占期,期间不再批准相同品种上市。药品上市许可持有人不履行供应保障承诺的,终止市场独占期。
—END—







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论