
近日,阿斯利康(AstraZeneca)和第一三共制药( Daiichi Sankyo)共同研发的乳腺癌药物Enhertu(德喜曲妥珠单抗,简称T-DXd,DS-8201)获批非小细胞肺癌新适应症,成为首款治疗非小细胞肺癌的HER2靶向药。
在获批之前, 4月份,Enhertu已获得了非小细胞肺癌的突破性治疗指定和优先审查,进入加速审批阶段。
基于Enhertu57.7%的客观缓解率和8.7个月的中位缓解持续时间,FDA加速批准Enhertu用于治疗不可切除或转移性HER2阳性,之前接受过全身治疗的非小细胞肺癌 (NSCLC) 的成年患者。阿斯利康和第一三共制药指出,由于是加速批准,FDA可能需要额外的临床数据以验证临床疗效。
HER2是一种酪氨酸激酶受体促生长蛋白,在多种肿瘤类型中表达,包括肺癌、乳腺癌、胃癌和结肠直肠癌。在NSCLC中,约2%~4%的病例发生HER2突变。

纪念斯隆-凯特琳癌症中心的Bob T. Li博士表示:“这是肺癌治疗的一个重要里程碑。经过二十年的研究之后,首个HER2靶向治疗方案的批准证实了HER2基因是肺癌靶向治疗的重要靶点,并标志着在治疗NSCLC方面向前迈出了重要一步。”
仅仅3年内,Enhertu已获批4项适应症,其余适应症为:
- 既往接受过基于抗HER2方案的不可切除或转移性HER2阳性乳腺癌成年患者;
- 用于治疗无法切除或转移性HER2-low(低表达) (IHC 1+ 或IHC 2+/ISH-) ,并且处于转移期时接受过化疗,或者是在辅助化疗期间或完成治疗后六个月内出现疾病复发的乳腺癌成年患者。
- 既往接受过基于曲妥珠单抗治疗的局部晚期或转移性HER2阳性胃癌或胃食管交界处腺癌的成年患者。
第一三共总裁兼首席执行官Ken Keller对Enhertu的批准和扩大适应症表示兴奋,并表示:“”此次批准强调了“Enhertu在HER2靶向药在肿瘤中的巨大潜力”。
阿斯利康肿瘤业务部门负责人Dave Fredrickson指出:HER2突变非小细胞肺癌是一种侵袭性的疾病,它通常影响年轻患者,治疗选择很少且预后不良。此次获批为这些患者提供了从靶向治疗中受益的机会,并强调了在诊断时检测预测标志物(包括肺癌中的HER2)的重要性,以确保患者接受针对其特定疾病的最合适的治疗。
据药融云数据库查询,Enhertu最早于2019年12月20日在美国首发上市,获批适应症为转移性乳腺癌。2020年3月又在日本上市,2021年1月又在欧盟获批,目前已在中国递交了上市申请,处于审评审批中。
Enhertu上市时间轴(部分)
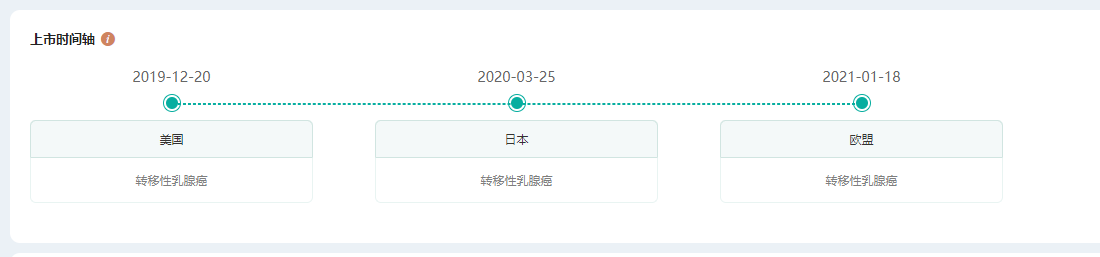
截图来源:药融云全球药物研发数据库
另外,据药融云数据库统计,阿斯利康/第一三共制药的Enhertu2021年在全球范围内共售卖3亿美元。随着其适应症的不断拓展,Enhertu的市场将会越来越宽广,未来潜力无限。
Enhertu全球销售情况
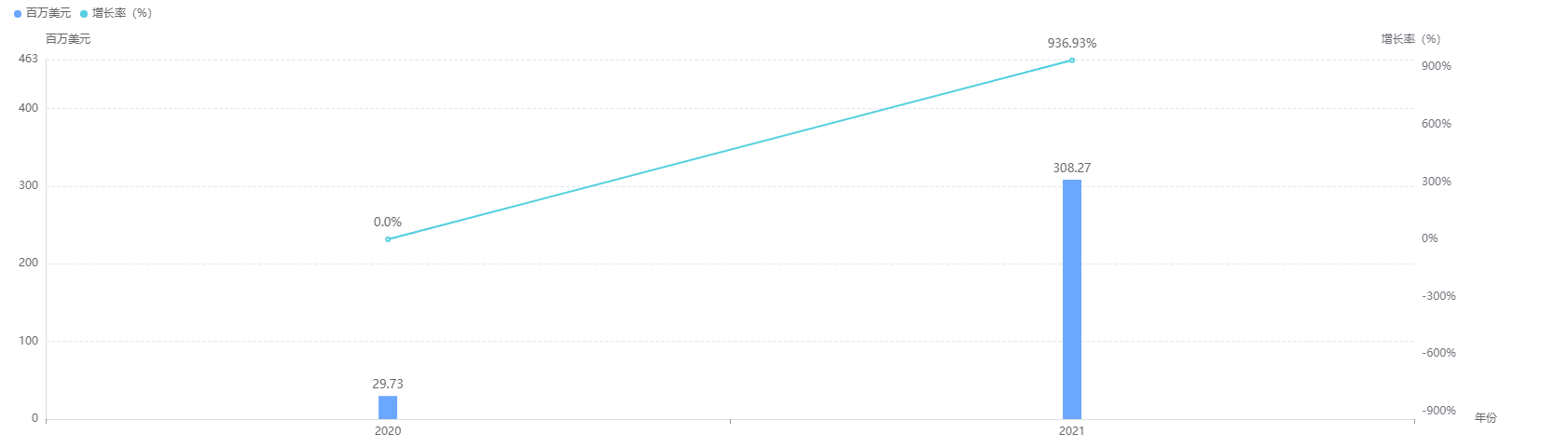
截图来源:药融云全球药物研发数据库
参考资料:
[1] https://www.biospace.com/article/astrazeneca-and-daiichi-sankyo-s-enhertu-becomes-first-her2-directed-therapy-for-nsclc/
[2] 药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论