
2022年7月8日,香雪制药旗下香雪生命科学技术(广东)有限公司(简称“香雪生命科学”)与中山大学肿瘤防治中心召开了细胞治疗产品TAEST16001治疗晚期软组织肉瘤的多中心、开放、单臂、II期临床研究项目启动会,标志着中国首个TCR-T细胞治疗产品进入临床研究新的阶段。
TAEST16001是由香雪生命科学自主研发的,中国首个获得IND批件的TCR-T细胞免疫治疗产品。在I期临床研究中,TAEST16001的安全性和有效性得到了初步验证,充分支持在晚期软组织肉瘤中继续开展II期临床研究。TAEST16001的I期临床研究以口头汇报形式在美国临床肿瘤学会(ASCO)2022年度年会中进行展示,其安全性和有效性的临床研究结果与国外知名药企同靶点产品的临床结果相当,获得了全球业界的高度关注。
TAEST16001药物基本信息
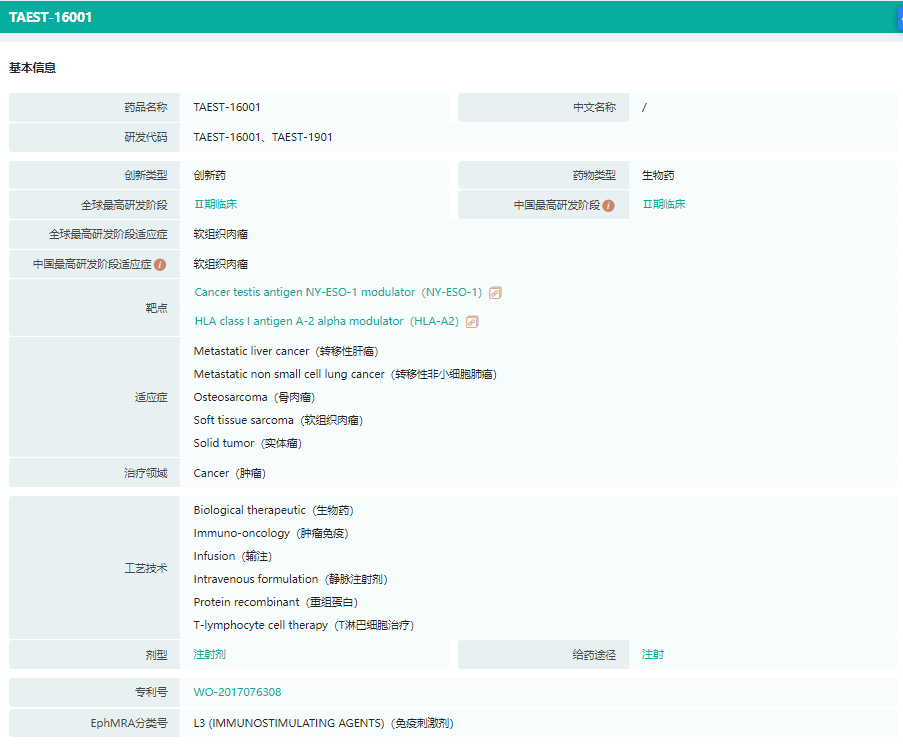
截图来源:药融云全球药物研发数据库
据药融云数据库显示,香雪制药TAEST16001针对软组织肉瘤的临床试验进展最快,已推进到临床2期。其他还有转移性非小细胞肺癌、实体瘤、骨肉瘤的临床试验均推进到1期。
TAEST16001适应症研发现状

截图来源:药融云全球药物研发数据库
目前,香雪生命科学有两个产品已在中国获得IND批件,其中第一个产品是TAEST16001,适应症为软组织肉瘤,目前正在进行II期临床研究;第二个产品是TAEST1901,适应症为原发性肝癌,即将启动I期临床研究。
参考来源:
[1] 证券日报网
[2] 药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论