
引言

当地时间2022年6月13日,专业RNAi治疗公司Alnylam Pharmaceuticals, Inc.宣布,美国食品药品监督管理局(FDA)批准了其开发的Amvuttra(vutrisiran),这是一款皮下注射给药的RNAi疗法,每三月注射一次,用于治疗成人遗传性转甲状腺素介导(hATTR)淀粉样变性的多发性神经病。
截图来源:药融云美国FDA药品批准数据库(新版)
关于hATTR淀粉样变性
遗传性转甲状腺素蛋白介导(hATTR)淀粉样变性是一种由TTR基因变异引起的罕见的、遗传性的、致命的退行性疾病。TTR蛋白主要在肝脏中表达,通常是维生素A的载体。TTR基因的变异会导致异常的淀粉样蛋白积聚并损害器官和组织,包括周围神经和心脏,导致周围感觉运动神经病、自主神经病和/或心肌病,以及其他疾病表现。hATTR淀粉样变性是一项未得到满足的主要医疗需求,影响全球约50,000人。确诊后的中位生存期为4.7年,心肌病患者的生存期更短(3.4 年)。
HELIOS-A研究
FDA对Amvuttra的批准是基于9个月的HELIOS-A III期研究的积极结果,研究显示Amvuttra显著改善了多发性神经病的体征和症状,超过50%的患者疾病停止或逆转。在这项全球性、随机、开放标签、多中心的III期研究中,164名hATTR淀粉样变性患者以3:1的比例随机接受每三个月一次皮下注射25mg vutrisiran (N=122) 或每三周一次静脉输注0.3 mg/kg patisiran(全球第一款RNAi药物,2018年获批用于治疗hATTR淀粉样变性) (N=42)18 个月。通过比较 HELIOS-A 中的Amvuttra组与来自具有里程碑意义的APOLLO III期patisiran研究的安慰剂组(n=77)来评估Amvuttra的疗效,这是一项在可比患者群体中进行的随机对照研究。Amvuttra达到了该研究的主要终点和所有次要终点。
关于Amvuttra™ (vutrisiran)
Amvuttra™(vutrisiran)是一种RNAi疗法,在美国获批用于治疗成人遗传性转甲状腺素介导(hATTR)淀粉样变性的多发性神经病。它是一种双链小干扰RNA (siRNA),可靶向突变型和野生型转甲状腺素蛋白(TTR)的信使RNA(mRNA)Amvuttra使用Alnylam公司的增强稳定化学(ESC)-GalNAc 偶联物递送平台,旨在提高效力和代谢稳定性,使得药物可以每三个月进行一次皮下注射给药。关键的HELIOS-A III期研究结果表明,Amvuttra可迅速降低血清中TTR的水平,有可能逆转相对于基线的神经病变损伤,并相对于外部安慰剂改善hATTR淀粉样变性多发性神经病患者疾病负担的其他关键指标。
关于Alnylam Pharmaceuticals, Inc.
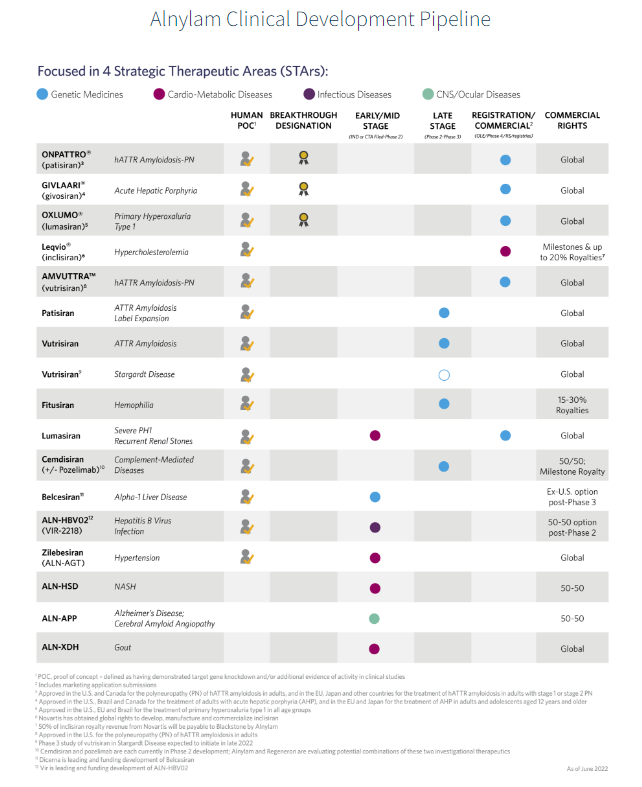
Alnylam引领RNAi创新药物开发,致力于改善患有罕见和流行疾病且需求未得到满足的患者生活。自20年前成立以来,Alnylam已开发且商业化的RNAi产品包括ONPATTRO®(patisiran)、GIVLAARI®(givosiran)、OXLUMO®(lumasiran)、Amvuttra™(vutrisiran)和 Leqvio®(inclisiran)。Alnylam拥有丰富的在研药物管线,包括五个处于后期开发阶段的候选产品:
参考来源:
[1] Alnylam官网
[2] 药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论