
目录
⊙海思科:BTK蛋白抑制剂在美国获批临床
⊙罗氏:与梯瓦制药达成创新战略合作
⊙赛诺菲:度普利尤单抗在欧盟获批新适应症
⊙信立泰:HFpEF药品SAL007临床试验申请获受理
⊙荣昌生物:PD-L1单抗注射用RC98获批临床
- 海思科:BTK蛋白抑制剂在美国获批临床
4月15日,海思科发布公告,其BTK蛋白抑制剂HSK29116美国临床试验申请(IND)获FDA许可。本次临床试验是评价该药在复发或难治性B细胞恶性肿瘤受试者中的安全性、耐受性和药代动力学/药效学。

截图来源:企业公告
据公告,HSK29116是海思科自主研发的靶向 BTK 的口服 PROTAC 小分子抗肿瘤药物,用于治疗复发难治 B 细胞淋巴瘤,是国内首款、全球第二款进入临床研究的 BTK-PROTAC 药物。该品种已于2021年4月获得国家药品监督管理局(NMPA)批准开展临床,目前国内和澳大利亚的临床剂量爬坡试验正在快速推进中,已开展到第四个剂量组,进展良好。美国临床将作为 HSK29116 全球多中心研究的重要组成部分,即将正式启动 I 期临床试验。
- 罗氏:与梯瓦制药达成创新战略合作
4月18日,罗氏制药宣布,与以色列知名制药企业梯瓦制药公司(以下简称“Teva”)达成合作协议,双方将整合各自优势资源进一步扩大原研的盐酸苯达莫司汀——存达®在中国的患者可及。
存达®是Teva公司自主研发的原研盐酸苯达莫司汀,于2018年在中国获批,是Teva公司上市的原研产品,用于治疗在利妥昔单抗或含利妥昔单抗方案治疗过程中/治疗后疾病进展的惰性B细胞非霍奇金淋巴瘤(NHL)。
- 赛诺菲:度普利尤单抗在欧盟获批新适应症
4月19日,赛诺菲(Sanofi)发布新闻稿称,欧盟委员会(EC)已扩大达必妥(度普利尤单抗)在欧盟的上市许可,批准其用于6~11岁,经中高剂量吸入型糖皮质激素(ICS)联合另一种维持治疗药物治疗后,控制不佳的2型炎症型重度哮喘患者的附加维持治疗方案。据赛诺菲新闻稿介绍,度普利尤单抗是唯一经欧盟批准适用于2型炎症型重度哮喘的生物制剂。
- 信立泰:HFpEF药品SAL007临床试验申请获受理
4月19日,信立泰公告,其重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液(国内项目代码:SAL007)临床试验申请获得受理。公司本次提交的申请为SAL007慢性心力衰竭的HFpEF(射血分数保留的心衰)适应症的I期临床试验申请。

SAL007(美国项目代码:JK07,下称“07”)是美国Salubris Bio自主研发、具有全球知识产权的NRG-1(神经调节蛋白-1)融合抗体药物,拟开发适应症为慢性心衰。
据悉,该产品是信立泰第一个中美双报的创新生物药,于2020年2月获得美国FDA临床试验批准,2020年9月获得中国CDE的临床试验批准。目前,美国Salubris Bio正进行HFrEF(射血分数减少的心衰)I期临床试验的第二剂量组入组,预计近期将完成入组;同时,正在准备HFpEF临床试验的启动工作。中国正进行HFrEF的I期临床试验。
- 荣昌生物:PD-L1单抗注射用RC98获批临床
CDE官网显示,近日荣昌生物的注射用RC98获批临床,治疗HER2表达胃癌。

截图来源:CDE官网
据了解,RC98为 PD-L1 单克隆抗体。此前曾获批临床,适应症为实体瘤,当前正在I/IIa期临床研究中。
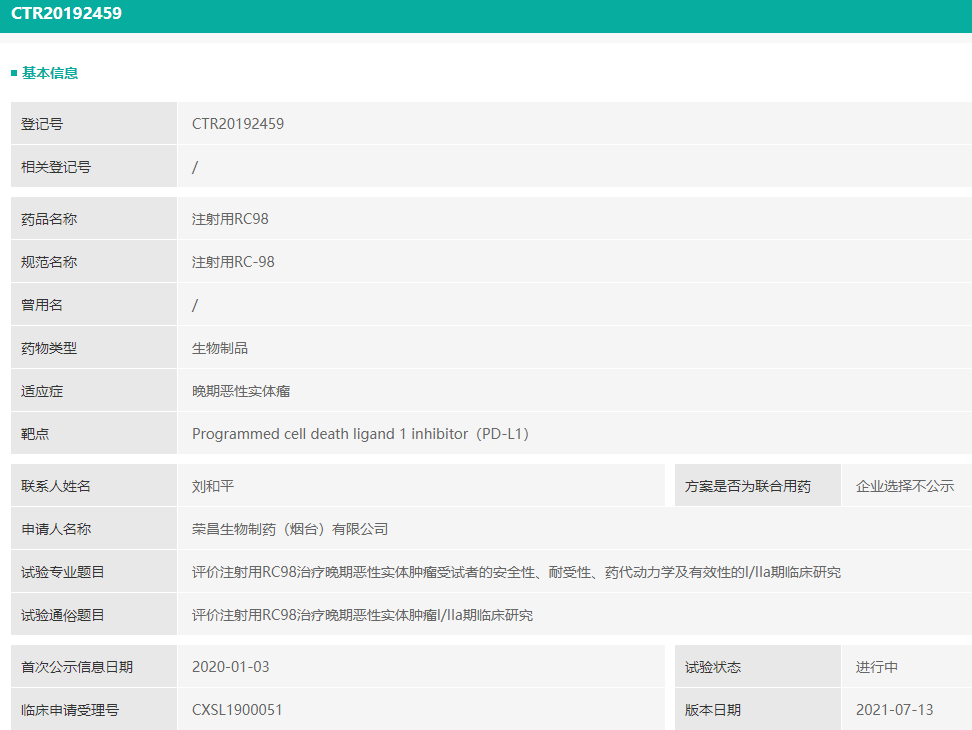
截图来源:药融云中国临床试验数据库
想要解锁更多药企创新药最新进展信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药申报情况、最新进展、研发阶段、临床试验、竞争格局、涉及靶点适应症、销售情况、市场规模与前景,可否投入研发与仿制!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论