据药融云全球药物研发、中国审评、中国临床、全球临床、中国药品批文等数据库统计:
·2021年7月,我国仅有一款新药上市为同路生物的生物类似药人凝血酶原复合物。
·10款新药提交NDA申请,其中5款提交新的适应症上市申请,5款新药即将面世。
·97款新药申请临床。
·百余款药物进入新的临床阶段:2款新药开展上市后Ⅳ期临床试验,17款新药开展Ⅲ期临床试验,18款新药开展Ⅱ期临床试验,72款新药开展Ⅰ期临床试验。
一、1款新药上市
2021年7月6日,NMPA批准同路生物的生物类似药人凝血酶原复合物上市,此次获批上市的适应症是凝血因子Ⅸ缺乏症。
表1 上市的新药 

数据来源:药融云全球药物研发数据库
二、10款新药提交NDA申请PD-1产品、非小细胞肺癌治疗药物扎堆
2021年7月,我国共有10款新药(化学药和生物药分别有5款)提交NDA申请,其中5款提交新的适应症上市申请,5款新药即将面世。
这10款新药共有4款PD-1产品,另有4款新药此次申请上市的适应症均为“非小细胞肺癌”,麻醉药龙头人福药业旗下热门新药递交新适应症申请,此外还有一款改良型新药上市在即。
表2 提交NDA申请的新药
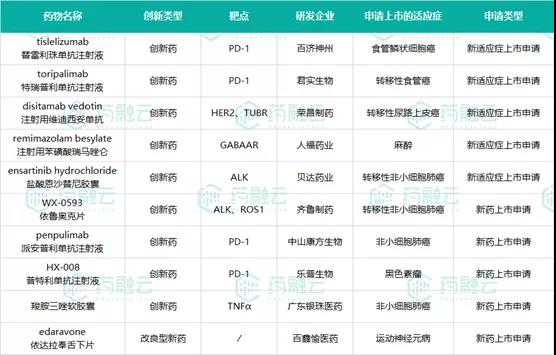
数据来源:药融云全球药物研发数据库
三、四款PD-1单抗
(1)首个国产PD-1单抗:提交第5项上市申请
7月30日,君实生物提交其自主研发的抗PD-1单抗特瑞普利单抗注射液(拓益)联合含铂化疗一线治疗“局部晚期或转移性食管鳞癌”的适应症上市申请,这也是特瑞普利单抗注射液在我国递交的第5项上市申请。
特瑞普利单抗注射液是我国批准上市的首个国产以PD-1为靶点的单抗药物,获批的第一个适应症为“既往接受全身系统治疗失败的不可切除或转移性黑色素瘤”。2020年12月,特瑞普利单抗成功通过国家医保谈判,被纳入新版目录。2021年3月,君实生物向FDA提交特瑞普利单抗上市申请。
(2)替雷利珠单抗注射液:申请第6项适应症
7月8日,百济神州提交替雷利珠单抗的新适应症上市申请,用于治疗“既往接受过一线标准化疗后进展或不可耐受的局部晚期或转移性食管鳞状细胞癌”,这是替雷利珠单抗在我国提交的第6项新适应症上市申请。
替雷利珠单抗注射液是百济神州的免疫肿瘤生物平台研发的第一款药物,是一款人源化lgG4抗程序性死亡受体1(PD-1)单克隆抗体,设计目的是为最大限度地减少与巨噬细胞中的Fcγ受体结合。
(3)派安普利单抗:提交新药上市申请
7月13日,中山康方生物提交派安普利单抗的上市申请,用于治疗“局部晚期或转移性鳞状非小细胞肺癌”。这是中山康方生物自主研发的重组人源化抗PD-1单克隆抗体,是目前唯一采用IgG1亚型且经Fc段改造的新型PD-1单抗,抗原结合解离速率更慢,晶体结构分析显示其具有独特的结合表位,能够持久阻断PD-1/PD-L1结合。
此外,派安普利单抗于今日(8月5日)正式获批上市,用于治疗“至少经过二线系统化疗复发或难治性经典型霍奇金淋巴瘤”。
(4)普特利单抗注射液:提交新药上市申请
7月5日,乐普生物提交其PD-1单抗普特利单抗注射液的上市申请,用于治疗晚期黑色素瘤。普特利单抗注射液是2018年乐普生物收购泰州翰中的PD-1产品,属于差异化设计的人源化单克隆抗体,在IgG4的Fc引入了S254T、V308P、N434A突变以延长半衰期。
四、首个国产ADC药物:提交新适应症上市申请
7月14日,荣昌生物提交维迪西妥单抗用于治疗“HER2过表达局部晚期或转移性尿路上皮癌”的新适应症上市申请。这是继6月8日注射用维迪西妥单抗在中国的附条件上市批准之后,维迪西妥单抗迎来的又一重磅消息。
维迪西妥单抗是我国自主研发的创新抗体偶联药物ADC新药,已先后获得中美两国药监局授予的突破性疗法认证,成为率先拿到美、中两国突破性疗法双重认定的ADC药物,而获认定的正是尿路上皮癌适应症。
维迪西妥单抗还是我国率先提交上市申请的靶向HER2治疗尿路上皮癌的ADC药物。维迪西妥单抗获批,打破了ADC药物领域无原创国产新药的局面,填补了全球HER2过表达胃癌患者后线治疗的空白,是我国自主创新生物药发展史上的一个里程碑。
首个国产“ALK突变晚期非小细胞肺癌”的1类新药
7月13日,贝达药业提交其盐酸恩沙替尼胶囊(贝美纳)用于治疗“间变性淋巴瘤激酶阳性的局部晚期或转移性非小细胞肺癌”的上市申请。
盐酸恩沙替尼是一种新型强效、高选择性的新一代ALK抑制剂,是贝达药业拥有完全自主知识产权的创新药,也是我国第一个用于治疗ALK突变晚期非小细胞肺癌的国产1类新药。2020年11月,盐酸恩沙替尼胶囊正式获批上市,用于治疗“此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或者转移性非小细胞肺癌(NSCLC)”的治疗。
五、依鲁奥克片:或成为第2款申报上市的国产ALK抑制剂
7月24日,齐鲁制药递交其1类新药依鲁奥克片的上市申请,这是齐鲁制药首款申请上市的1类新药。依鲁奥克片是齐鲁制药自主研发的新型ALK/ROS1抑制剂,可抑制不同融合类型的野生型以及ALK抑制剂耐药突变的ALK激酶活性,同时可有效抑制不同融合类型ROS1激酶的活性。
六、17款新药进入临床三期
2021年7月,17款开展Ⅲ期临床试验的新药中,有11款是创新药,6款是生物类似药。
从企业来看,和记黄埔表现亮眼,有2款新药开展临床三期试验;恒瑞、正大天晴、海思科、康宁杰瑞等大型药企也有新药纷纷开展临床三期试验。
表3 进入临床三期的新药
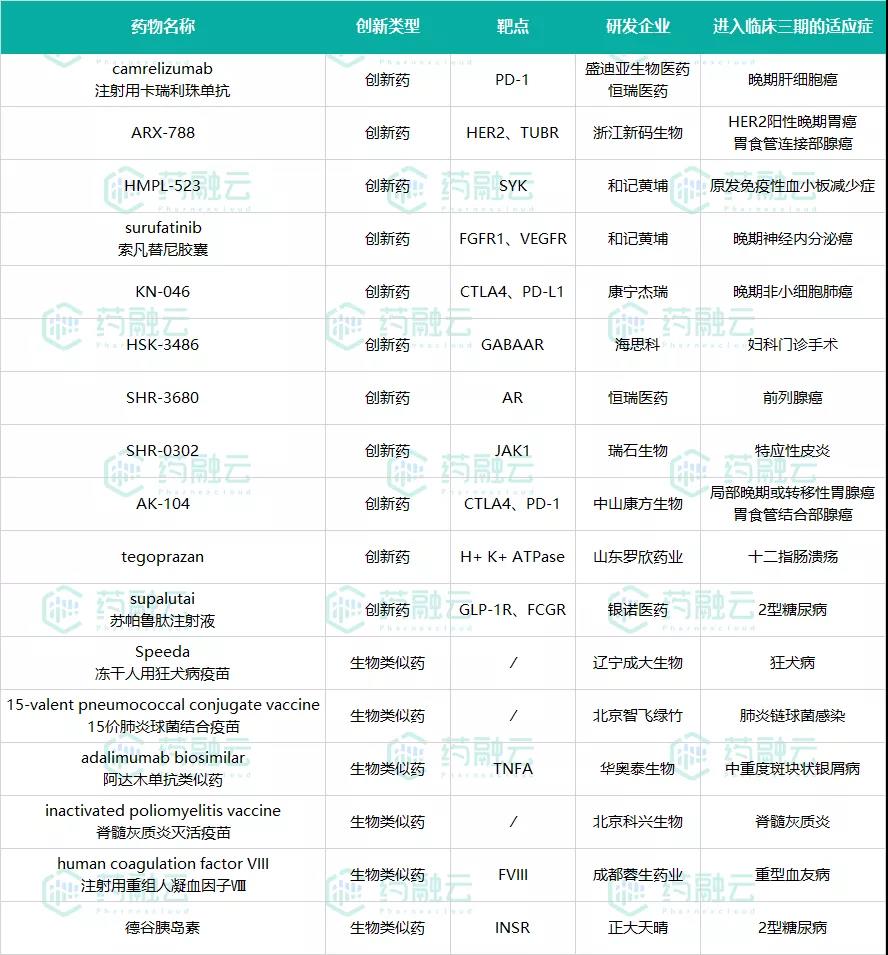
数据来源:药融云全球药物研发数据库





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论