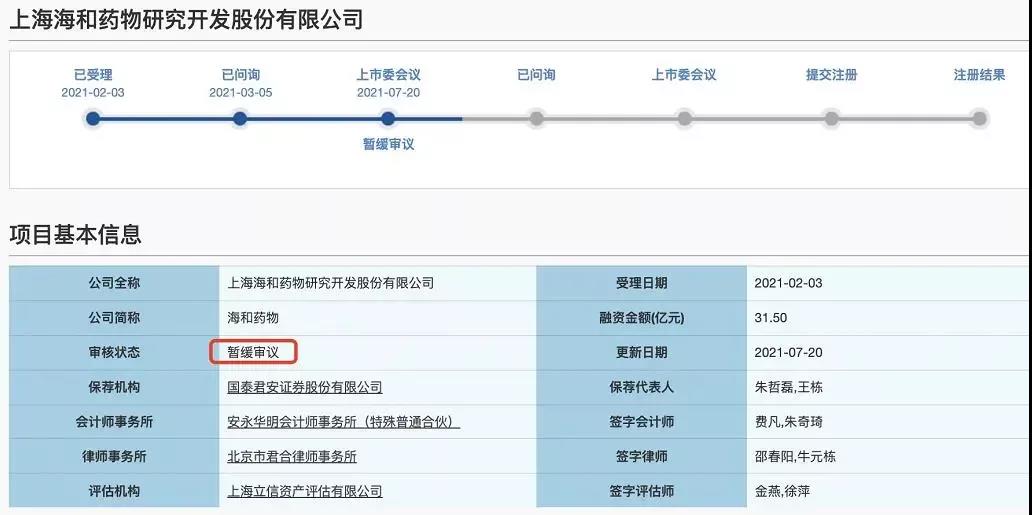
2021年7月20日,上交所发布科创板上市委2021年第48次审议会议结果公告显示,上海海和药物研究开发股份有限公司(简称“海和药物”)IPO进程踩下刹车,结果是暂缓审议。
暂缓审议并不代表IPO失败,据数据显示:去年15家被暂缓表决的企业,已有13家企业二次上会,都获通过!
但是这次伴随着暂缓审议的,是发审委罕见的极其犀利的质询。上市委对海和药物现场问询了四个问题,涉及研发能力、核心产品、关联交易和国有资产流失,可谓是一针见血,直指核心。
1、“买买买”模式下,海和药物创新能力大受质疑
关于研发能力,上市委要求海和药物说明以下三点:
核心技术在主要产品研发中发挥的具体作用,发行人是否独立自主对引进或合作开发的核心产品进行过实质性改进并做出实质性贡献?
是否主要依靠授权引进或合作研发引入相关产品管线而对第三方技术存在重大依赖,发行人关于“具有独立自主的研发能力,技术研发体系完备,不存在核心技术依赖于第三方的情形”的自我评价,是基于历史事实还是基于未来展望?
结合发行人已开展二期以上临床试验的核心产品均源自授权引进或合作研发的情况,分析发行人是否符合《上海证券交易所科创板股票发行上市审核规则》规定的第五套上市标准?
翻译一下上市委的三句话的核心意思:买买买的模式下,海和药物自己的创新能力在哪?

受到问询,海和药物是怎么回应的呢?他的研发管线到底如何?为何会引来上市委如此犀利的质询?
2、研发管线覆盖多个靶点,严重依赖License in与合作研发
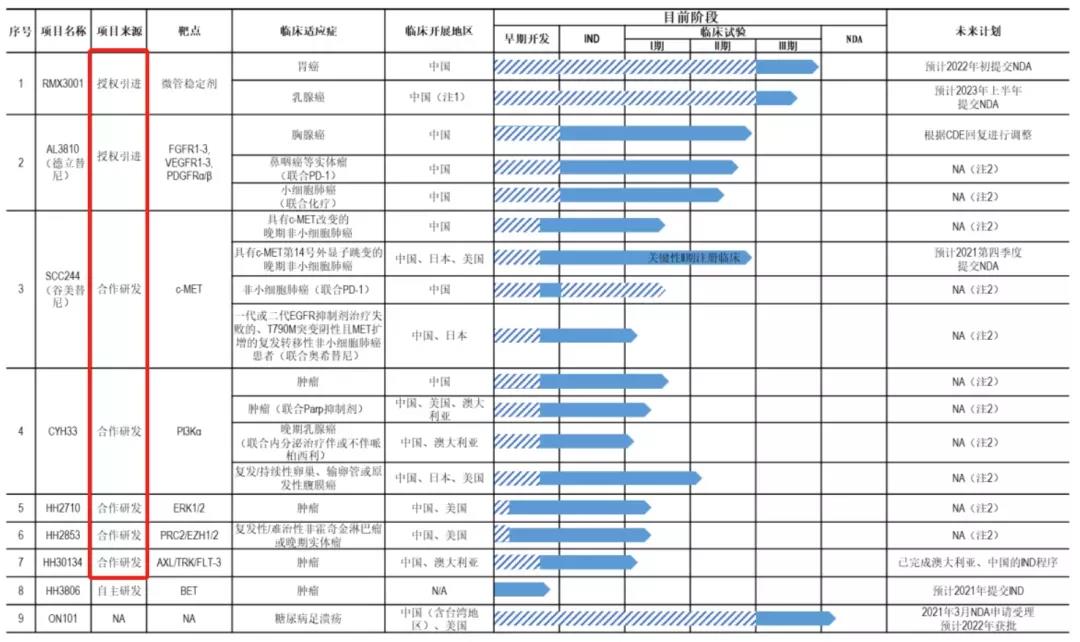
梳理海和药物的招股书及对问询函的回复,可以了解到,自2011年成立以来,海和药物共有9条研发管线,涵盖FGFR、VEGFR、c-MET、PI3Kα、ERK、PRC2、ALX/TRK/FLT3等多个热门靶点,整体管线中替尼类品种较多。
然而,在这9个核心产品中,除HH3806项目外,其余均为授权引进(License in)或合作研发。
要么是通过授权引进,获得相关专利的授权许可。如RMX3001项目、德立替尼项目;
要么是上海药研所等科研机构完成专利发明,海和药物再与其签署合作研发协议,通过专利权变更成为专利权人;
还有一种情况是海和药物与上海药研所分工完成专利发明工作,再共同申请专利。
可以看出海和药物就是一家靠着“License in”这种买买买模式进入生物医药研发行列的一家创新药企,可以说是资本模式下的药物研发企业。
那么,海和药物的这9条研发管线进展如何?
3、处于临床后期的核心产品,上市可能性、商业化存疑
截至 2021 年 6 月 30 日,海和药物现阶段在抗肿瘤领域重点推进的 8 款化合物中,仅有1款进入III期临床,其余均在I/II期临床甚至更早阶段。
- RMX3001 项目的胃癌、乳腺癌适应症均处于 III 期临床试验阶段;
- AL3810 (德立替尼)多项适应症均处于 II 期临床试验阶段;
- SCC244 (谷美替尼)处于关键性 II 期注册临床试验阶段;
- CYH33/HH2710/HH2863/HH30134等共5款产品处于 I 期临床试验阶段;
- HH3806 项目处于临床前研究阶段。
重点来看看其中两项核心产品的研发进度和市场销售情况:
RMX3001(口服紫杉醇):在韩国迄今未有收入
关于口服紫杉醇,海和药物2017年就已经获得韩国大化授权,取得了该药物在中国大陆、中国台湾、中国香港和泰国这些授权区域的独占许可。目前在国内,口服紫杉醇正在进行III期临床试验,用于晚期胃癌患者的二线治疗。截至2021年3月,已完成361例患者入组,预计于2022年初提交新药上市申请。
RMX3001 在韩国获批上市后,由于韩国大化未能与韩国医疗保障的主管机构就销售价格达成一致,至今仍未产生销售收入。国内紫杉醇类药物存在多个不同剂型的已上市产品,市场竞争极为激烈,口服紫杉醇前景如何,笔者对此不抱乐观态度。
AL3810(德立替尼):预期疗效或不尽人意
海和药物仅拥有AL3810在中国的权益,海外权益由Clovis持有。若AL3810在其他国家或地区的临床开发失败,或产品上市后临床治疗效果不及预期,对AL3810在中国境内的适应症拓展或后续商业化造成不利影响。
其中,施维雅、Clovis 曾在多项研究指出,尽管AL3810 单药治疗对乳腺癌患者具有疗效,但与历史数据的相比,其疗效不太可能显著高于标准治疗。
2021 年 7 月,公司与 CDE 开会讨论了 AL3810 胸腺癌临床试验方案的修订策略,CDE 建议公司继续保持盲态,并就试验的统计假设等关键参数的修订策略提出建议。海和药物预计,AL3810关于胸腺癌适应症的新药上市申请将推迟,后续研发计划及上市申请时间需根据药审中心回复进行调整。
鉴于该药物相关适应症临床试验进展情况,其上市可能性和市场前景都是很值得思考的一个问题。
这意味着,海和药物不仅靠买买买获得多条研发管线,核心研发能力缺失,并且这些买来的产品能否顺利在国内上市,实现商业化也存疑。
在这样的情况下,海和药物迄今为止的收益如何呢?
4、连续多年亏损,海和药物将何去何从?
自2011年成立以来,海和药物研发管线的9个核心产品中,有7个产品进入临床开发阶段,并有4个获得美国IND默示许可。但至今尚无产品上市。
招股书显示,海和药物成立于2011年,主营业务为抗肿瘤创新药物的发现、开发、生产及商业化,注册资本为6.63亿元,实控人为丁健,合计拥有29.41%的表决权。海和药物业绩长期处于亏损状态。
2018年至2020年,海和药物营业收入分别为0.19亿元、0.15亿元、0亿元,净亏损分别为4.28亿元、3.01亿元、7.09亿元。截至2020年末,其累计未分配利润为-7.55亿元。此次IPO暂缓对海和药物的研发推进将是一个不小的挑战。
海和药物的科创板IPO暂缓审议,也是释放了一些信号:鼓励引进优质项目、鼓励原创性药物发现,对于“License in”拼凑管线上市、创新成色不足的Biotech,正在慢慢say no!
加上不久前CDE发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则(征求意见稿)》这一背景,希望国内的新药研发能做到以满足临床需求为导向,而非单纯的资本游戏。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论