导读:
信达生物内幕消息公告显示,2020年PD-1单抗销售收入超22亿人民币,这家成立仅仅十年的创新生物药公司是如何成长起来的,背后的产品管线到底长啥样?本文将会带你一探究竟。
PD-1全年大卖22亿
2021年1月29日,信达生物发布内幕消息公告,其PD-1单抗达伯舒(信迪利单抗注射液)2020年全年销售收入超过22亿元人民币,第四季度超过7亿元人民币。作为首个进入国家医保目录的PD-1抑制剂,达伯舒(信迪利单抗注射液)2020年收入实现同比大幅增长。

发展历程
信达生物由俞德超博士于2011年创立,俞德超博士,先后任美国Calydon生物制药公司主管新药研发副总裁,美国Cell Genesys生物制药公司首席科学家,美国Applied Genetics生物制药公司副总裁,中美合资康弘赛金药业有限公司首任总裁,成都康弘生物科技有限公司共同创始人,董事总经理,成都康弘药业集团副总裁,生物大分子蛋白药物四川省重点实验室首任主任。曾发明了世界上首款基于溶瘤病毒的免疫治疗药物安柯瑞(Oncorine),并共同发明及主导开发了国内首款创新型全人源抗体类治疗药物康柏西普。
公司自成立以来,信达生物获得了富达、君联、淡马锡、红杉、高瓴等多家全球知名创投基金资本支持,并于2018年10月在香港联交所主板顺利上市,截止2021年2月8日收盘,市值已达到1378亿港元。
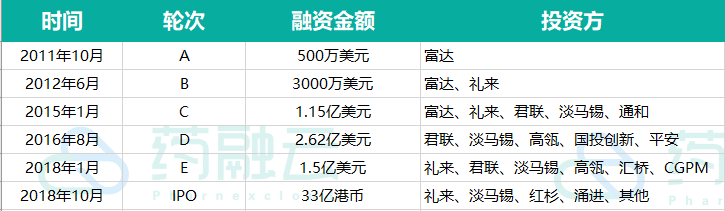
数据来源:公司公告
产品管线

图片来源:信达生物官网
根据信达生物官网,目前产品管线共计34项。从分子类型来看,生物药物31项,小分子药物3项。从临床阶段来看,已上市(包含在美国上市)6项,提交上市申请3项,临床3期9项(包含在美国临床进展),临床2期5项,临床1期11项。
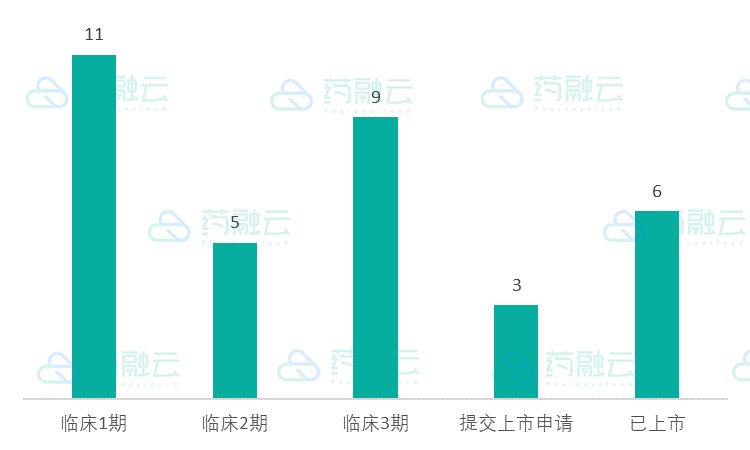
从适应症来看,肿瘤29项,新陈代谢2项,移植物抗宿主病1项,自身免疫1项,眼底病1项。
肿瘤
肿瘤无疑是信达产品管线的主旋律,产品管线总计34项,肿瘤占了29项,而肿瘤中的重中之中要数拳头产品信迪利单抗,也就是2020年大卖22亿元的PD-1单抗,信迪利单抗于2018年12月获准上市,获批适应症为经二线系统化疗的复发或难治性经典型霍奇金淋巴瘤。而在不久前,2021年2月2日,信迪利单抗第二个适应症获批上市,联合注射用培美曲塞二钠和铂类一线治疗非鳞状非小细胞肺癌。

该项新适应症报上市是基于一项随机、双盲、III期对照临床研究(代号:ORIENT-11);ORIENT-11 研究是一项评估达伯舒®(信迪利单抗注射液)或安慰剂联合力比泰®(注射用培美曲塞二钠)和铂类用于晚期或复发性非鳞状非小细胞肺癌一线治疗有效性和安全性的随机、双盲、III期对照临床研究(ClinicalTrials.gov, NCT03607539)。
主要研究终点是由独立影像学评审委员会根据 RECIST v1.1 标准评估的无进展生存(PFS)。次要研究终点包括总生存期(OS)、安全性等。
ORIENT-11 研究共入组 397 例受试者,按照 2:1 随机入组,分别接受达伯舒®200mg或安慰剂联合力比泰®和铂类治疗,每 3 周给药 1 次,完成 4 个周期治疗后,进入达伯舒®或安慰剂联合力比泰®维持阶段,治疗直至疾病进展、毒性不可耐受或其他需要终止治疗的情况。对照组疾病进展后可有条件交叉至达伯舒®单药治疗。
中期数据显示,达伯舒®(信迪利单抗)联合力比泰®(注射用培美曲塞二钠)和铂类能够在此类患者人群中显著延缓疾病进展。中位随访时间 8.9 个月,试验组和对照组由独立影像学评审委员会评估的中位 PFS 分别为 8.9 个月和 5.0 个月。安全性特征与既往报道的达伯舒®(信迪利单抗注射液)研究结果一致,无新的安全性信号。

此外,信迪利单抗还有3项已提交上市申请,7项临床试验正在开展。其中有2项为单用新适应症,分别为2线肺鳞癌和2线食管鳞癌,其中2线肺鳞癌已提交上市申请,2线食管鳞癌处于临床2期;5项信迪利单抗联合化疗,其中1线肺鳞癌已提交上市申请,1线胃癌、1线胃癌(CPS>10)、1线食管癌和2线霍奇金淋巴瘤处于临床3期。2项信迪利单抗联合贝伐珠单抗,其中1线肝癌适应症已提交临床,EGFR+TKI耐药非小细胞肺癌处于临床3期。1项信迪利单抗联合利妥昔单抗,适应症为黑色素瘤,正处于临床3期。
另外信达上市的三款生物类似药贝伐珠单抗、阿达木单抗和利妥昔单抗都是知名品种,不再做过多介绍。另外一款与Incyte合作的pemigatinib(研发代码IBI375)目前已在国内提交上市申请。2020年4月17日,FDA加速批准Incyte公司pemigatinib,用于治疗既往接受过治疗的携带成纤维细胞生长因子受体2(FGFR2)融合或重排的局部晚期或转移性胆管癌患者,批准时间比预定的5月30日审批日期提前了一个半月,这也是FDA批准的首个胆管癌靶向疗法。2018年12月17日,信达生物制药和Incyte公司共同宣布:达成战略合作和独家授权许可协议,推进pemigatinib、itacitinib及parsaclisib的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。
新陈代谢
新陈代谢领域共计2项,分别为临床3期的IBI306和临床2期的IBI362。IBI306(其他研发代码:LY-3305677、OXM-3)由礼来公司研发,2019年8月22日,信达生物制药宣布与礼来制药达成战略合作,共同推进胃泌酸调节素创新化合物(OXM-3)在中国的开发和商业化。
OXM-3是一款处于临床开发中期阶段的潜在同类最优的胰高血糖素样肽-1(GLP-1)和胰高血糖素受体双重激动剂。在早期临床试验中,OXM-3胃泌酸调节素分子已显示出有效的控制血糖及减轻受试者体重方面的作用,体现了其在治疗糖尿病、肥胖及非酒精性脂肪性肝炎(NASH)方面的潜在疗效。
自身免疫
自身免疫领域目前有1项正处于临床1期,研发代码为IBI112。IBI112是白介素-23(IL-23)抗体,IL-23是一种由活化的巨噬细胞和树突状细胞分泌的具有促炎效应的细胞因子。2020年9月1日,IBI112的I期临床研究完成中国首例健康受试者给药。
移植物抗宿主病
移植物抗宿主病目前有1项正在进行临床试验,代码为IBI377。这款药物也是由Incyte研发,是上文中提到的2018年12月17日,信达生物制药和Incyte达成战略合作和独家授权许可协议,推进pemigatinib、itacitinib及parsaclisib的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。
IBI377即为itacitinib,这是一款JAK1抑制剂,值得关注的是,2020年1月3日,Incyte宣布itacitinib治疗急性GVHD的三期临床未能达到主要重点。而目前国内,信达生物只在进行移植物抗宿主病的临床试验,目前处于临床2期,而Incyte在美国已将该适应症推进到3期。
眼底病
眼底病目前有1款药物正处于临床1期,代码为IBI302,这是一款全球首创的眼科抗VEGF-抗补体双靶点药物。
IBI302的I期研究是一项单臂,开放的、多中心的单次给药的剂量递增临床研究,旨在评估新生血管性年龄相关性黄斑变性(nAMD)患者中单次玻璃体腔注射IBI302后的安全性和耐受性。
已经完成的I期临床研究共纳入31例受试者,所有受试者均接受单次玻璃体腔注射IBI302。该临床研究未报告严重不良事件和剂量限制性毒性,展现出了IBI302良好的安全性与耐受性。给药后一周后,即可观察到受试者视力提高以及视网膜水肿的减轻。
给药后28天,31例受试者的平均最佳矫正视力较基线提高6个字母;平均中央区视网膜厚度较基线减少141.2微米,且部分患者的疗效持续到了给药后6周。
结语
成立仅仅十年的信达生物获得今天的成绩值得称道,其发展历程和运营模式值得学习。
当然背后也离不开每一个普通打工人的努力,相信临床行业的小伙伴都知道信达的临床进度压力是业内公认的大,信达生物的发展速度也体现了我们这一代医药人在创新药领域奋力追赶的状态与精神。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论