
2022年底,Disc Medicine宣布完成与Gemini Therapeutics的合并,合并后的公司以Disc Medicine的名义运营,之前的Disc Medicine股东拥有74%的公司股份,Gemini Therapeutics的股东拥有26%。在2021年2月,Gemini Therapeutics刚完成与FS Development的合并,两公司合并后就以Gemini Therapeutics之名存续运作。接连的合并,似乎在诠释这个行业生存的不易。
从药融云数据库获悉,Disc Medicine成立于2017年,由风险投资机构Atlas Venture和Brian MacDonald创立,总部位于美国马萨诸塞州,是一家临床阶段的生物制药公司,主要专注于为患有严重血液疾病的患者发现、开发和商业化新疗法。

药融云数据库:公司融资情况
Disc Medicine在与Gemini Therapeutics完成合并的同时,就完成了由Access Biotechnology牵头的医疗保健投资者财团的5350万美元融资。2023年2月,完成由贝恩资本生命科学公司领投的6250万美元融资;6月,完成其承销公开发行的普通股,收益总额约为1.578亿美元;时隔一年,2024年6月,Disc Medicine宣布以每股36.00美元的价格承销发行490多万股普通股,本次总收益预计约为1.78亿美元。截止2024年6月21日,Disc Medicine公司市值13.11亿美元。截止发稿前,市值为13.7亿美元(约合100亿人民币),每股46.19亿美元。

· 管线均由外部引进
Disc Medicine通过创新为血液病患者带来希望,公司目前的研发管线涵盖罕见的遗传疾病到与慢性病相关的贫血等领域。管线具体进展情况如下:

1. Bitopertin
Bitopertin是一种口服小分子GlyT1(甘氨酸转运蛋白1)抑制剂,正在研究用于治疗红细胞生成性卟啉病。2022年12月FDA授予Bitopertin用于治疗红细胞生成性原卟啉病的孤儿药资格。甘氨酸是血红素生物合成的必需前体,GlyT1是维持发育中的红细胞内足够水平的甘氨酸所必需的,作为血红素合成的调节剂,Bitopertin通过抑制GlyT1可以减少PPIX(原卟啉IX)积累并提高耐光性。红细胞生成性卟啉病(EP)包括红细胞生成性原卟啉病(EPP)、X连锁原卟啉症(XLPP)和先天性红细胞生成性卟啉症(CEP)三种亚型,是由血红素合成失调引起的罕见遗传性疾病,当患者暴露在阳光下时,卟啉会被激活,并对周围组织造成氧化损伤,引起皮肤极度疼痛、起泡和水肿等,同时患者还会因卟啉积累出现胃肠道并发症。目前还没有批准的疾病改善疗法,唯一的治疗方法是造血干细胞移植。目前的患者护理方法包括采取极端措施避免日光,如将户外活动限制在夜间或使用防护服和不透明防护罩,以及疼痛管理。

2021年5月,Disc Medicine宣布从罗氏获得了Bitopertin和相关备用化合物的所有开发、制造和商业化的全球独家许可。罗氏获得Disc Medicine的预付款以及总计超过2亿美元的潜在开发、监管和商业里程碑。临床前研究显示Bitopertin可减少PPIX的积累,PPIX是导致EPP和XLP患者疾病病理的毒性代谢物。2022年8月Disc Medicine宣布启动Bitopertin在EPP或XLP患者中的临床试验2期研究(BEACON试验)。BEACON试验是一项随机、开放标签、多剂量临床试验,旨在评估Bitopertin在EPP或XLP患者中的安全性、耐受性和有效性。2024年6月Disc Medicine在欧洲血液学协会(EHA)大会上公布了BEACON试验的数据,结果显示Bitopertin耐受性良好,血红蛋白无明显变化,在低剂量和高剂量下显著降低PPIX,且在多项阳光耐受性指标中观察到显著改善。
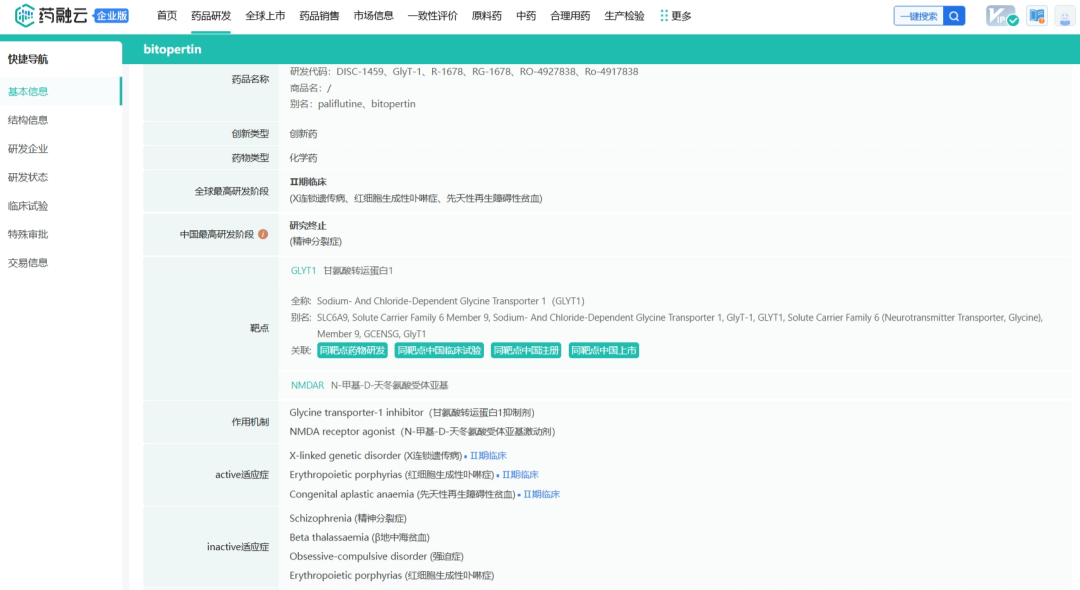
药融云数据库:研发基本信息
2022年10月,Disc Medicine宣布启动一项Bitopertin在成人EPP患者中的临床试验2期研究(AURORA试验),AURORA试验是一项随机、双盲、安慰剂对照、平行给药试验,旨在评估Bitopertin在成人EPP患者中的安全性、耐受性和有效性。在美国各地招募约75名患者,患者接受口服Bitopertin 120天,剂量为20或60mg/每日一次。2024年6月Disc Medicine公布了AURORA试验的数据,结果显示Bitopertin总体耐受性良好,迄今为止未报告严重不良事件(SAE);与安慰剂相比,PPIX在20mg和60mg剂量下显著降低;PPIX的降低与多种光耐受性测量的改善有关。

此外,2023年3月,Disc Medicine宣布与美国国立卫生研究院(NIH)的国家心肺血液研究所(NHLBI)合作,以评估bitopertin在Diamond-Blackfan贫血(DBA)患者中的临床试验2期研究。2023年7月宣布第一位患者已入组。其中先天性纯红细胞再生障碍性贫血(PRCA),又称为Diamond-Blackfan贫血(DBA),是一种罕见的、以单纯红系造血衰竭为特点的先天性骨髓衰竭综合征。
2、DISC-0974
2019年10月,Disc Medicine与艾伯维签订独家许可协议,获得了DISC-0974和相关分子的全球权利。DISC-0974是一种在研的first-in-class单克隆抗体,旨在通过抑制铁调素通路的高选择性和关键靶点血红蛋白(HJV)共受体来抑制铁调素的产生。铁调素是铁稳态的主要调节激素,通过限制铁的吸收和防止内部铁储存的部署而起核心作用。DISC-0974通过抑制铁调素和增强红细胞生成的铁可用性,目前正在开发为多种炎症性贫血的潜在治疗方法。

临床前研究表明,DISC-0974抑制铁调素并增加血清铁。2021年7月,Disc Medicine启动了DISC-0974的临床试验1期研究,这项研究在健康志愿者中采用单次递增剂量设计,以评估DISC-0974的安全性和耐受性,并研究抑制HJV对铁调素和铁参数的影响。2022年6月公布了临床试验1期研究的结果,数据显示,血清铁和红细胞生成标志物强劲增加,铁调素水平有所降低,并且DISC-0974在健康志愿者中耐受性良好。
2022年6月还启动了一项临床试验1b/2期研究,旨在评估DISC-0974在骨髓纤维化贫血(MF)患者中的安全性、耐受性和有效性。2024年6月报告的临床试验1b期研究(剂量递增阶段)的最新数据显示,DISC-0974在所有评估剂量水平上均显示出了可接受的安全性和耐受性;在每次给药后数周内,患者体内的铁调素水平显著降低,血清铁增加。预计2025年获得临床试验2期研究的顶线数据。

药融云数据库:研发基本信息
此外,Disc Medicine还在2023年2月启动了DISC-0974在非透析依赖性慢性肾脏病(NDD-CKD)贫血患者中的临床试验1b/2期研究,该研究评估DISC-0974在NDD-CKD贫血患者中的安全性、耐受性和有效性。预计2025年取得临床试验2a期研究的顶线数据。
3、DISC-3405
2023年1月,Disc Medicine与中国上海的迈威生物旗下全资子公司迈威(美国)达成独家许可协议,根据协议,Disc Medicine获得在研品种9MW3011(靶向TMPRSS6的单克隆抗体组合,迈威的项目号为MWTX-001、MWTX-002和MWTX-003)在除大中华区和东南亚以外所有区域内独家开发、生产和商业化以及以其他方式开发的权利。

其中处于临床试验1期的MWTX-003也就是现在的DISC-3405,通过靶向铁调素的TMPRSS6(跨膜丝氨酸蛋白酶6,也称为matriptase-2,通过裂解膜结合的共受体血红蛋白下调铁调素表达)提高铁调素水平以降低铁水平,最初计划开发其用于治疗真性红细胞增多症以及其他铁超负荷疾病,有望在未来成为全球范围内首个调节体内铁稳态的大分子药物。临床前研究表明,DISC-3405在各种β-地中海贫血和真性红细胞增多症的动物模型中,铁调素产生有所增加且血清铁水平得到了抑制。

Disc Medicine于2023年10月启动了一项针对健康志愿者的临床试验1期研究。该研究是一项随机、双盲、安慰剂对照的单次递增剂量的试验,主要评估DISC-3405的安全性、耐受性、药代动力学和药效学。截至目前公布的SAD部分的初步数据显示,DISC-3405总体耐受性良好,在所有剂量水平下,铁调素显著依赖性增加,血清铁相应的有所减少;150mg和300mg剂量的平均血清铁比基线减少50%以上;300 mg剂量下,平均血清铁降低超过50%至少持续4周,选择性血液学参数(CHr、血红蛋白和血细胞比容)显著降低。
· 财务状况
2023年度Disc Medicine的研发费用为6930万美元,上年同期为3340万美元,研发费用的增加主要是由于Bitopertin和DISC-3405等研究的启动以及员工人数的增加。一般和行政费用为2190万美元,上年同期为1400万美元,该项的增加主要是由于作为员工人数增加和成本增加。净亏损7640万美元,上年同期净亏损4680万美元,这一增长主要是由于2023年度运营成本增加。

2024年第一季度(截至2024年3月31日)研发费用为2370万美元,上年同期为2020万美元,研发费用的增加主要是由于bitopertin正在进行的两项临床研究和药物生产,以及员工人数的增加;一般和行政费用为780万美元,上年同期为490万美元,该想的增加也是由于员工人数增加;净亏损为2690万美元,上年同期为2280万美元。

Disc Medicine截至2024年3月31日的现金和现金等价物为3.426亿美元,目前的资金预计将维持公司运营到2026年。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐
参考来源:
[1] CDE/NMPA官网
[2] 药融云数据库
[3] FDA/EMA/PMDA
[4] 相关公司公开披露(除标注外,正文图片均来自企业官网)
https://www.discmedicine.com/
https://www.discmedicine.com/publications-and-supporting-literature/
https://mabwell.com/news_info/id-102.html
<END>
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论