
声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐,相关用药请谨遵医嘱。
2024年1月5日,Ligand Pharmaceuticals宣布,美国FDA批准其旗下“first-in-class”药物Zelsuvmi(berdazimer外用凝胶,10.3%)用于成人和一岁及以上儿童传染性软疣患者的治疗。据其报道,Zelsuvmi为FDA批准用于治疗传染性软疣的首个新型药物。这款药物可在家庭或其他非临床环境中由患者、家长或看护人员使用,是治疗这种具高度传染性的病毒性皮肤感染的首个局部使用处方药。
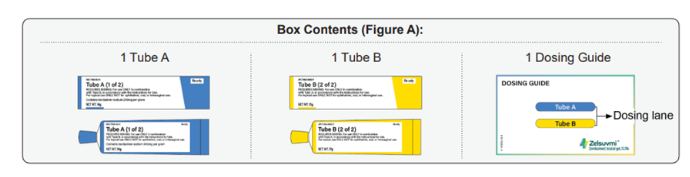
图1:Zelsuvmi组成
传染性软疣简介
传染性软疣因痘病毒科中的传染性软疣病毒感染所致,属于儿童十分常见的皮肤病毒感染性疾病,位列全球五大流行的皮肤病之中。近年来,传染性软疣的患病率呈逐年上升的趋势,躯干、腋窝、肘前窝、腘窝及大腿根部内侧皱褶处最常受累。
软疣的传播是通过人与人之间皮肤的直接接触、间接接触和自我接种进行传播。病毒潜伏期为1周~6个月不等,通常为2~6周。临床表现为皮肤上出现2~5mm表面光滑、硬质的圆顶状丘疹,皮损呈肤色至红色,中央有一个呈脐状的病毒核心,伴或不伴瘙痒。该病具有很高自限性,积极治疗可限制病变扩散到其他部位、减少传染他人的风险并缓解其引发的瘙痒症状能避免因皮损发炎、遭受创伤或继发感染而遗留瘢痕等。
Zelsuvmi的获批是一项突破,标志着临床医生首次可以用一种有效的外用处方药来治疗软疣。
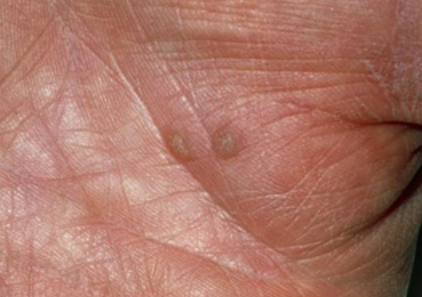
图2:手掌软疣案例
Zelsuvmi简介及其临床试验结果
Zelsuvmi的活性成分Berdazimer是一种一氧化氮释放剂。一氧化氮已被证明具有抗病毒特性。虽然Zelsuvmi治疗软疣的作用机制尚不清楚。不过,Zelsuvmi的疗效已在B-SIMPLE4和B-SIMPLE2这两项三期试验中得到证实。这些试验表明,Zelsuvmi能够减少皮损数量,而且每天使用一次的耐受性良好。
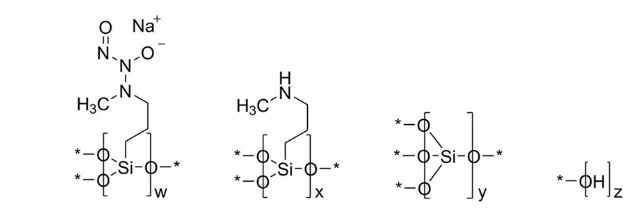
图3:Zelsuvmi的有效成分
Zelsuvmi的疗效在3项针对软疣患者的多中心、随机、双盲、平行组、载体对照试验中进行了评估(试验1、2和3分别为NCT04535531、NCT03927703和NCT03927716)。试验1共招募了891名受试者,试验2共招募了355名受试者,试验3共招募了352名受试者。
在三项试验中,3%的受试者年龄小于2岁,96%的受试者年龄在2至17岁之间。试验人群中51%为男性,88%为白人,6%为黑人,6%为其他族裔;21%的受试者为西班牙裔/拉丁美洲人,78%为非西班牙裔/拉丁美洲人,1%的受试者未作报告。主要疗效终点是在第12周达到完全清除的受试者比例。完全清除的定义是在评估时受试者的MC病变总数为0。关键的次要疗效终点是第8周时的完全清除率。

图4:试验1和试验2中软疣受试者第12周和第8周的完全清除率
在临床实验3中,Zelsuvmi组和对照组在第12周的完全清除率分别为26%和22%,95%的置信区间为(-5%,14%)。
临床常用的其他治疗手段
在临床对于软疣患者有多种治疗方法,对软疣患儿父母的调查发现,他们主要关心治疗相关的疼痛、治疗效果、是否可能导致疤痕、皮疹的瘙痒、传染性等。因此,治疗目标应尽量减少疼痛、疤痕和其他不良反应,同时加快恢复时间。
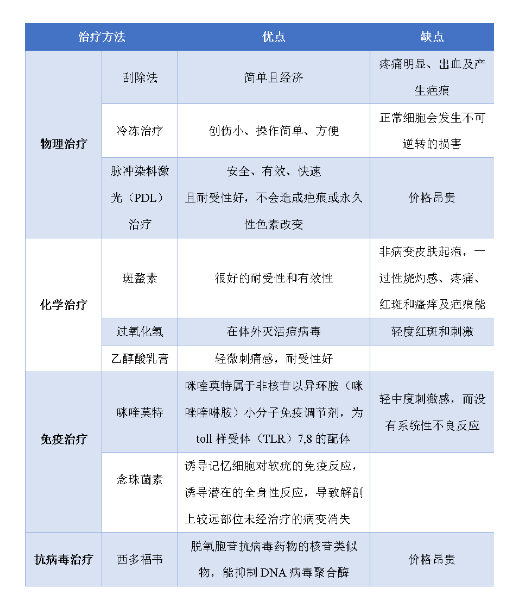
图5:其他治疗手段
其他治疗包括局部热疗、水杨酸、儿茶素软膏、外用印度檀香油等,这些治疗缺乏高质量的临床研究证据,但无明显不良反应,容易被患儿及其家属接受。这样的治疗可能对多种治疗耐受的患者有一定的帮助。
小结
Zelsuvmi的获批使得患者、家长或看护人可在家中、医生办公室或其他医疗环境之外使用,以治疗这种传染性极强的病毒性皮肤感染,极大的提高了患者的适应性和依从性,改善患者的治疗体验。期待Zelsuvmi可以为更多患者带来惊喜,也期待后续有更多相关研究,加快药物研发上市,造福患者。
参考资料:
1.FDA官方网站:https://www.fda.gov/
2.于鹏,卫风蕾.儿童传染性软疣治疗进展[J].儿科药学杂志,2021,27(12):57-60.
3.Ligand Pharmaceuticals官网:U.S. Food and Drug Administration Approves ZELSUVMI™ as a First-in-Class Medication for the Treatment of Molluscum Contagiosum
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论