2022年全年,FDA一共批准(或暂时性批准)了914个ANDA,其中暂时性批准172个,正式批准742个。从数量上看,相比2021年的669个有明显的提升,但仍然不及2017-2020年间的水平。由于美国仿制药竞争高度激烈,仿制药的投资回报率较低(就如FDA报告中所说,普瑞巴林胶囊的平均价格在一年内下降了95%),故近年来ANDA的申报积极性有所回落,而且近35%的产品从来没有在美国上市。因为竞争过于激烈,近年来仿制药都是拼首仿,比难度的游戏,尽管只有为数不多的几个产品面临专利悬崖,但FDA已经提前批准了“暂时性的”ANDA。

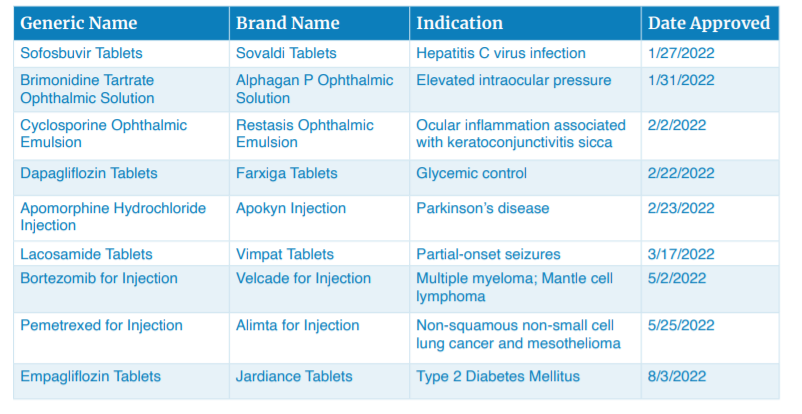
2022年,FDA仿制药办公室一共批准了106个首仿药,其中意义最为重大的仿药包括索非布韦片、溴莫尼定滴眼液、环孢素滴眼液、达格列净片、阿扑吗啡注射液、拉考酰胺片、注射用硼替佐米、注射用培美曲塞、恩格列净片等。
具有重大意义的首仿药
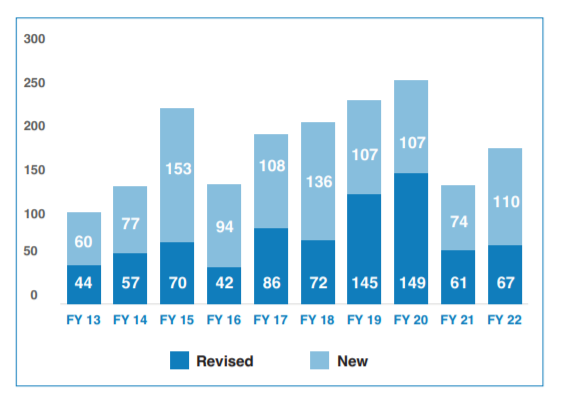
2015年之后,价格下降导致的市场萎缩超过了销量增长所带来的增量,美国仿制药市场开始逐渐萎缩,但为了进一步增加仿制药竞争,FDA制定了一揽子的“药品竞争行动计划”(FDA Drug Competition Action Plan)。虽然FDA加大了仿制药的审批,但制药企业对几乎“无利可图”的美国仿制药丧失了积极性,为了进一步加大仿制药的竞争,FDA也是“操透了心”,通过各种措施来提高仿制药的积极性,为高度复杂产品审评审批进行了多种尝试,发布或修订了大量的产品专业指南(product specific guidance)。
FDA新发或修订的产品专业指南

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论